Il calore e la temperatura sono un argomento strettamente correlato e, in quanto tale, la differenza tra i due può essere un po ‘ confusa. La differenza principale è che il calore si occupa di energia termica, mentre la temperatura è più interessata all’energia cinetica molecolare.
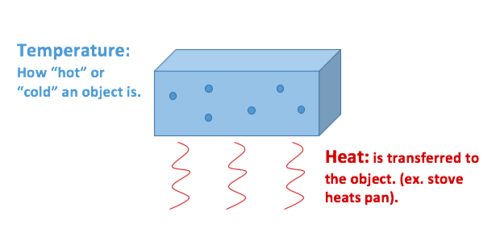
Il calore è il trasferimento di energia termica, mentre la temperatura è una proprietà che l’oggetto esibisce.
Qual è la differenza?,
Il calore descrive il trasferimento di energia termica tra molecole all’interno di un sistema e viene misurato in Joule. Il calore misura come l’energia si muove o scorre. Un oggetto può guadagnare calore o perdere calore, ma non può avere calore. Il calore è una misura del cambiamento, mai una proprietà posseduta da un oggetto o sistema. Pertanto, è classificato come variabile di processo.
La temperatura descrive l’energia cinetica media delle molecole all’interno di un materiale o sistema e viene misurata in gradi Celsius (°C), Kelvin(K), Fahrenheit (°F) o Rankine (R)., È una proprietà fisica misurabile di un oggetto, nota anche come variabile di stato. Altre proprietà fisiche misurabili includono velocità, massa e densità, per citarne alcuni.
Somiglianze
Il calore è un trasferimento di energia termica causato da una differenza di temperatura tra le molecole.
Nota:
L’energia termica può essere altrimenti intesa come l’energia cinetica e potenziale microscopica totale di un sistema.,
Seconda legge della termodinamica
La seconda legge della termodinamica è un argomento complesso che richiede uno studio intensivo nel campo della termodinamica per comprendere veramente. Tuttavia, ai fini di questo articolo, solo un piccolo aspetto deve essere compreso e cioè il fatto che il calore fluirà sempre spontaneamente dalle sostanze più calde a quelle più fredde. Questa semplice affermazione spiega perché un cubetto di ghiaccio non si forma all’esterno in una giornata calda o perché si scioglie quando viene lasciato cadere in una ciotola di acqua tiepida.,
Thought experiment
Immaginate il cubo di ghiaccio di cui sopra caduto in una ciotola di acqua calda—il ghiaccio deve guadagnare calore (energia termica) dall’acqua nella ciotola (vedi paragrafo precedente). L’aggiunta di energia termica porta ad un aumento dell’energia cinetica della molecola di ghiaccio e quindi ad un aumento della temperatura. Questo è noto perché la temperatura è in realtà la misura dell’energia cinetica media delle molecole. Inoltre, il ghiaccio continuerà a guadagnare energia termica causando le sue molecole a muoversi più velocemente e alla fine rompere i loro legami intermolecolari o sciogliersi.,
In conclusione, il trasferimento di calore o energia termica in genere cambierà la temperatura della sostanza, ma non sempre! Ad esempio, nel momento in cui il ghiaccio nella ciotola si trasforma in acqua, quelle molecole d’acqua saranno alla stessa temperatura di quando erano ghiaccio. In questo caso, invece dell’energia termica che fa il lavoro per aumentare l’energia cinetica, funziona per rompere i legami intermolecolari, causando un cambiamento di stato., Tuttavia, col passare del tempo la temperatura del ghiaccio recentemente fuso aumenterà fino a quando tutto all’interno della ciotola raggiunge l’equilibrio—il che significa una temperatura costante in tutto.
Per ulteriori letture
- Calore
- Temperatura
- Energia termica
- Energia cinetica
- Energia interna
- O esplorare una pagina casuale