Le strutture altamente organizzate delle proteine sono veramente capolavori dell’architettura chimica. Ma le strutture altamente organizzate tendono ad avere una certa delicatezza, e questo è vero per le proteine. Denaturazione è il termine usato per qualsiasi cambiamento nella struttura tridimensionale di una proteina che la rende incapace di svolgere la sua funzione assegnata. Una proteina denaturata non può fare il suo lavoro. (A volte la denaturazione è equiparata alla precipitazione o alla coagulazione di una proteina; la nostra definizione è un po ‘ più ampia.,) Un’ampia varietà di reagenti e condizioni, come calore, composti organici, cambiamenti di pH e ioni di metalli pesanti possono causare la denaturazione delle proteine.
|
Method |
Effect on Protein Structure |
|---|---|
|
Heat above 50°C or ultraviolet (UV) radiation |
Heat or UV radiation supplies kinetic energy to protein molecules, causing their atoms to vibrate more rapidly and disrupting relatively weak hydrogen bonding and dispersion forces., |
|
Uso di composti organici, come l’alcool etilico |
Questi composti sono in grado di impegnarsi nel legame intermolecolare dell’idrogeno con molecole proteiche, interrompendo il legame intramolecolare dell’idrogeno all’interno della proteina., |
|
Sali di ioni di metalli pesanti, come il mercurio, argento e piombo |
Questi ioni formano forti legami con gli anioni carbossilato di acido amino acidi, o i gruppi SH della cisteina, interrompendo legami ionici e legami disolfuro. |
|
Reagenti alcaloidi, come l’acido tannico (utilizzato nella concia della pelle) |
Questi reagenti si combinano con gruppi amminici caricati positivamente nelle proteine per interrompere i legami ionici., |
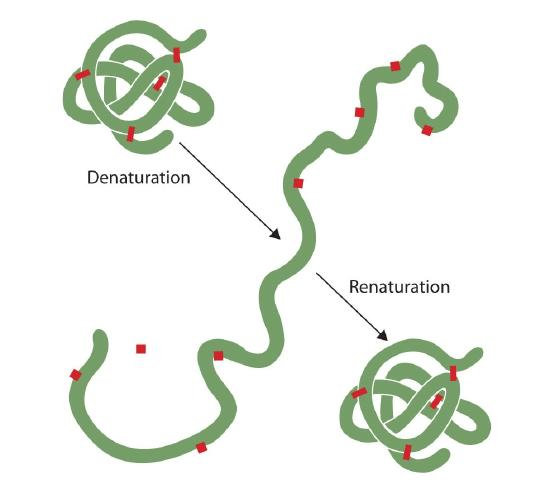
Chiunque abbia fritto un uovo ha osservato la denaturazione. L’albume chiaro diventa opaco mentre l’albumina denatura e coagula. Nessuno ha ancora invertito quel processo. Tuttavia, date le circostanze appropriate e il tempo sufficiente, una proteina che si è sviluppata in condizioni sufficientemente delicate può ripiegarsi e può nuovamente mostrare attività biologica (Figura 2.5.1). Tale evidenza suggerisce che, almeno per queste proteine, la struttura primaria determina la struttura secondaria e terziaria., Una data sequenza di aminoacidi sembra adottare la sua particolare disposizione tridimensionale (3D) naturalmente se le condizioni sono giuste.
Le strutture primarie delle proteine sono abbastanza robuste., In generale, sono necessarie condizioni abbastanza vigorose per idrolizzare i legami peptidici. Ai livelli secondari attraverso quaternari, tuttavia, le proteine sono abbastanza vulnerabili agli attacchi, anche se variano nella loro vulnerabilità alla denaturazione. Le proteine globulari delicatamente piegate sono molto più facili da denaturare rispetto alle proteine dure e fibrose di capelli e pelle.
Sommario
Le proteine possono essere suddivise in due categorie: fibrose, che tendono ad essere insolubili in acqua, e globulari, che sono più solubili in acqua. Una proteina può avere fino a quattro livelli di struttura., La struttura primaria consiste nella sequenza aminoacidica specifica. La catena peptidica risultante può formare un foglio α-elica o β-pieghettato (o strutture locali non facilmente classificate), che è noto come struttura secondaria. Questi segmenti di struttura secondaria sono incorporati nella struttura terziaria della catena polipeptidica piegata. La struttura quaternaria descrive le disposizioni delle subunità in una proteina che contiene più di una subunità., Quattro tipi principali di interazioni attraenti determinano la forma e la stabilità della proteina piegata: legame ionico, legame idrogeno, legami disolfuro e forze di dispersione. Un’ampia varietà di reagenti e condizioni può causare lo sviluppo o la denatura di una proteina.