Bevezetés
a lipáz katalizálja a lipidek lebontását a zsírsavak észtereinek hidrolizálásával. Funkciója fontos az emésztéshez, valamint a zsírok felszívódásának elősegítéséhez a belekben. A lipáz elsősorban a hasnyálmirigyben található és szekretálódik, de megtalálható a nyálban és a gyomorban is.
- hasnyálmirigy-lipáz (PDB ID: 1hpl), amely a jobb oldalon látható, egy karbonsav-észter-hidroláz. Gyakran nevezik hasnyálmirigy-triacil-glicerin lipáznak is, enzimosztályának száma pedig E. C. 3.1.1.3 .,
- az epesó által stimulált lipáz (bssl) megtalálható az anyatejben.
- a hormonérzékeny lipáz (LIPE) számos észtert hidrolizál. A részleteket lásd hormonérzékeny lipáz.
- a Monoacil-glicerin-lipáz (MAGL) az intracelluláris triglicerideket zsírsavvá és glicerinné hidrolizálja. MAGL együtt működik LIPE. A részleteket lásd monoglicerid lipáz.
az enzim által katalizált reakció az alábbiakban látható.
további bontás végül 2-monoacilglicerint és szabad zsírsavat eredményez ., A mechanizmus részletes megvitatása a lipáz-katalitikus mechanizmus szakaszban található. A lipáz szerkezetének és működésének meghatározása fokozatos folyamat volt. A lipáz aktivitást először Claude Bernard mutatta be a hasnyálmirigyben 1846-ban. Mattson és Beck azonban csak 1955-ben mutatták ki a hasnyálmirigy-lipáz magas specificitását a triglicerid primer észterek esetében . Az utóbbi években a hasnyálmirigy-lipáz kristályszerkezetének meghatározása vált az elsődleges fókuszba, mivel sok tudós dolgozott ezen.,
Lásd
- Molekuláris Játszótér/Hasnyálmirigy Lipáz
- Lipáz fedél morph
- a Hormon érzékeny lipáz
- Lipáz a Candida antarktisz zárt állami
- Jelent lipáz
- az Emberi gyomor lipáz
- Lipáz (héber)
- a Lipid-anyagcsere
Szerkezet
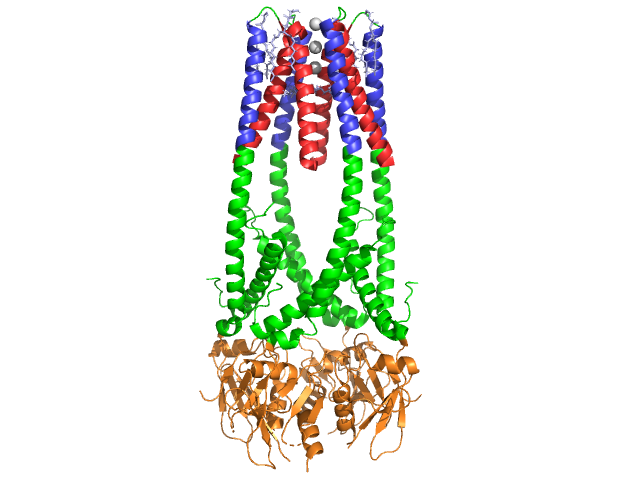
Hasnyálmirigy lipáz 50 kDa-os fehérje., Míg a kristálytani aszimmetrikus egység két azonos láncot tartalmaz, az 1hpl adatfájlban szereplő információ (Megjegyzés 350) azt jelzi, hogy a dimer kristályosodási tárgy, valamint hogy a funkcionális forma (más néven biológiai egység) egyetlen lánc (monomer). A lánc 449 maradékból áll . A s lipáz (az egyik alegység) tartalmazza 102 maradékok, amely létrehozni 13 alfa helices, pirossal, illetve a 139. maradékok vett részt a béta lapok összesen 28 szál, azt az aranyat. Az alfa helices a fehérje 22% – át teszi ki, míg a béta lapok 30% – ot tartalmaznak., Minden lánc két jól definiált . Az N terminális tartományt, kék színnel jelölve, alfa / béta-hidroláz hajtás jellemzi. Míg a C terminal domain, zölden látható, tartalmaz egy béta lap szendvics, amely kölcsönhatásba lép colipase . A lipáz minden monomer – és dimerszerkezetét diszulfidkötések, hidrogénkötések és elektrosztatikus kölcsönhatások (sóhidak) tartják össze. A lipáz összesen 12 ciszteinmaradék között van. az Arg és Lys pozitív töltésű nitrogénjei (kék), az ASP és Glu maradékai között negatív oxygens (piros) képződnek., (sárga) szintén stabilizálja az enzimet a fő lánc és az oldallánc atomjai között. A lipáz a maradványok külön eloszlása (a lila spacefill poláris maradványokat jelent). A hidrofób összeomlás hozzájárul a másodlagos és tercier struktúrák nagy részéhez, mivel a (fehéren látható) a fehérje belsejét alkotja, míg a poláris maradványok (átlátszó kék) a felszínen vannak . Ezenkívül a lipáznak kettő van . Az egyik minden monomer alegységben van eltemetve. A kalcium-ion nélkülözhetetlen a fehérje-és enzimaktivitáshoz ., A képen a Glu187, Arg190, Asp192 és Asp195 szermaradványok által koordinált a alegységben található zöld kalciumion látható. A Ca (+2) töltést negatív töltésű glutamát-és aszpartátmaradványok, valamint két vízmolekula (rózsaszín) oxigénatomjai stabilizálják.
ezenkívül a lipáz egyedülálló (zöld), amely blokkolja az oldószert az aktív helyre való belépéstől (piros). A fedél egy 25 maradék spirális szerkezet, amely védi az oxyanion lyukat., A fedél (sárga), különösen fontos, hogy a szubsztrát kötés, ahogy megy egy drámai változás, amely megváltoztatja a másodlagos szerkezet a lipáz kötőhely a (aktív az oldalon piros), hogy egy (aktív az oldalon, kék, triacylglyceride a spacefill) (lásd a Lipáz fedél morph egy animáció, az átmenet). A fedél nyílását a másodlagos szerkezet megváltozása kíséri, a többnyire béta-kiterjesztett megerősítésről egy olyan struktúrára, ahol az aktív hely több mint fele alfa-helikákból áll .,
A Kolipáz koenzim
a lipázt kolipáz, egy koenzim aktiválja, amely kötődik a lipáz C-terminális, nem katalitikus doménjéhez. A kolipáz egy 10kda fehérje, amelyet a hasnyálmirigy inaktív formában választ ki. Öt konzervált (sárga színben látható) , és 2 – hidrofil felület (a lipáz C-terminális interakció helye – kék színben látható) és egy hidrofób felület (több hidrofób hurkot tartalmaz a lipid áthidalására – fehérben ábrázolva). A tripszin ezután aktiválja a kolipázt, mielőtt a kofaktor kölcsönhatásba léphet a lipázzal.,
a lipáz aktiválásához a Kolipáznak jelen kell lennie, és hidat képez a lipáz és a lipid között. Amikor a kolipáz kötődik, az aktív lipáz stabilizálódik a triacil-gliceridekkel való hidrofób kölcsönhatás érdekében . A kolipáz jelenléte nélkül az amfifilek felhalmozódása a duodenumban lévő olaj/víz interfészen megakadályozná a hasnyálmirigy lipáz kötődését a szubsztrátjához. . A kolipáz és a lipáz a C-terminálon lévő aktív helyekkel szemben helyezkedik el (az érintkezők rózsaszín és sárga területek, a vízmolekulák sötétebb kékben jelennek meg). Az enzimeket poláris kölcsönhatások kötik, mint például, és .,
kolipáz jelenlétében aktiválódik az enzim, amely a 216-239 aminosavakból álló (piros, aktív zöld) helyet mozgatja. Az N-terminál fedél összehangolt módon mozog a C-terminál doménnel együtt, hogy felfedje az aktív helyet (zöld), lehetővé téve, hogy egy hordozóval kötődjön. Feltételezzük, hogy ennek a rugalmasságnak jelentősége lehet A kolipáz-lipáz komplexnek a víz-lipid interfészhez való kötődésében. A szárny átszervezése egy második konformációs változást is idéz elő, amely létrehozza az oxianion lyukat.,
lipáz katalitikus mechanizmus
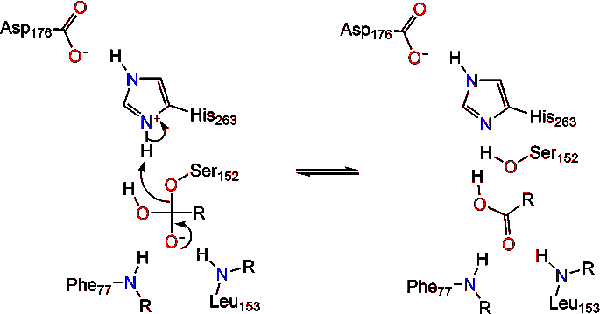
lipáz aktiválás a triacil-gliceridek lipid-víz interfészén kolipáz és epesók jelenlétében interfacialis aktiválásnak nevezik. A hidrolízisre adott reakcióhoz a kolipáz a lipázt a micelle lipid-víz membránjához rögzíti, ami felületi változást okoz a lipázon. A kolipáz négy hidrofób hurka kölcsönhatásba lép a triacil-glicerid hidrofób légkörével. Ez kezdeményezi a lipidhez kötődő aktív helyet, a fedél nyílását, hogy felfedje a triacil-glicerin hidrofób környezetét., Ez viszont lehetővé teszi a triacil-glicerin számára, hogy kölcsönhatásba lépjen a kulcsfontosságú aktív helymaradványokkal, mint például a katalitikus triád. A természetben sokféle lipáz enzim található. Bár a különböző formák különböző fehérjeállványokat foglalnak el, a legtöbb alfa – / béta-hidroláz hajtásra épül, és olyan kimotripszinszerű, amely savas maradékból, hisztidinből és szerin nukleofilből áll. A ló hasnyálmirigy-lipáz esetében a katalitikus triád a következőkből áll . Ez a katalitikus triád úgy működik, mint a természetben található legtöbb., Először is, az aszparaginsav hidrogénkötést képez a 263-mal, növelve a hisztidin imidazol nitrogén pKa-ját. Ez lehetővé teszi, hogy a hisztidin erős általános bázisként működjön, és deprotonálja a szerint. A deprotonált szerin ezután nukleofilként szolgálhat, és megtámadhatja az egyik zsírsav észter-karbonilját a lipid szubsztrát glicerin gerincének 1 vagy 3 karbonján. A lipid megtámadása után negatív töltésű tetraéderes közbenső képződik (1.reakció). Az oxyanion lyukban két maradékkal stabilizálódik:.,
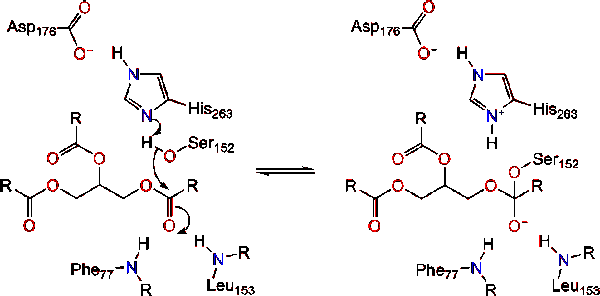
a karbonilreformok a glicerin gerinchálózat elhagyó csoportként működő szegmensével (2.reakció).
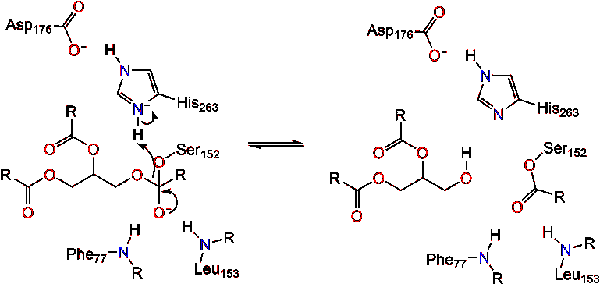
egy vízmolekula ezután protont ad a hisztidinnek, ami reaktív hidroxil anionot hoz létre. A hidroxil-anion ezután megtámadhatja a lipid karbonil-szénét, amely egy másik negatív töltésű tetraéderes közbenső anyagot képez, amely stabilizálódik az oxianion lyukban (3.reakció).,
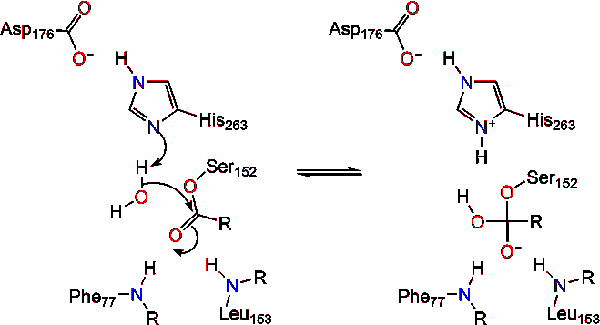
a karbonil reformálásakor a katalitikus szerin felszabadul, és a monoglikerid és a zsírsav monomerek szétszóródnak (4.reakció).
A hasnyálmirigy-lipáz gátlása
(lila), a C11 alkil-foszfonát a hasnyálmirigy-lipáz kompetitív inhibitora. Közvetlenül az aktív helyzsebben kötődik. Öt B-oktilglukozid (szürke és piros) molekula is van, amelyek a lipázhoz kapcsolódnak., A MUP hidrogénkötéseket képez a következőkkel: Ser 152 és His 263, amelyek a katalitikus triád részét képezik, valamint Phe 77 és Leu 153, amelyek az oxianion lyukban található stabilizáló maradványok .MUP kimutatták, hogy van der Waals kapcsolatok hidrofób oldalláncok Ala 178, Phe 215, Pro l80, Tyr ll4, Leu 213(kék).
fehérje-szubsztrát kölcsönhatások
a lipáz számos hidrofób érintkezéssel kötődik. Amint itt látható, a lipáz kölcsönhatásba lép a koleszteril-linoleát alkilcsoportjával a fehérje hidrofób hasadásán keresztül., Ez a szakadás irányítja a molekulát, hogy optimalizálja a lipolízis reakciót.
ebben a jelenetben látható a Candida rugosa élesztőből származó lipáz két kolészteril-linoleát (szürke) molekulával. Az aktív lelőhelymaradványok, köztük a Ser152, az Asp176 és a His263, piros pálcika ábrázolásban láthatók. A lipáz két lipidmolekulát képes befogadni, mivel két azonos alegység katalizálja az azonos reakciót. Egy lipáz molekula egyszerre két lipolízis reakciót katalizálhat.,
klinikai jelentősége
a hasnyálmirigy-lipáz a hasnyálmirigy csatornarendszerén keresztül kiválasztódik a duodenumba. Egészséges egyénben nagyon alacsony koncentrációban van a szérumban. A hasnyálmirigy-funkció, például a hasnyálmirigy-gyulladás vagy a hasnyálmirigyrák szélsőséges megzavarása esetén a hasnyálmirigy elkezdheti megemészteni magát, és felszabadíthatja a hasnyálmirigy enzimeket, beleértve a hasnyálmirigy-lipázt a szérumba. A hasnyálmirigy-lipáz szérumkoncentrációjának mérése ezért segíthet az akut pancreatitis diagnózisában.., Mivel a lipáz aktivitása az emésztés és a zsír felszívódását, volt egy növekvő piac lipáz inhibitorok fogyás gyógyszerek. A legnépszerűbb az orlisztát (vagy Xenical®), amely a Streptomyces toxytricini természetes terméke, a lipostatio hidrogénező terméke-visszafordíthatatlan lipáz inhibitor. Ez az inhibitor a Ser152 kötésével is működik, olyan észtert termel, amely olyan lassan hidrolizál, hogy gyakorlatilag visszafordíthatatlan .
lipáz 3D struktúrái
lipáz 3D struktúrák