a fehérjék magasan szervezett struktúrái valóban a kémiai építészet mesterművei. De a magasan szervezett struktúrák általában egy bizonyos finomsággal rendelkeznek, ez igaz a fehérjékre. A denaturáció a fehérje háromdimenziós szerkezetének bármilyen változására használt kifejezés, amely képtelenné teszi a hozzárendelt funkciójának elvégzésére. A denaturált fehérje nem tudja elvégezni a munkáját. (Néha a denaturáció megegyezik egy fehérje kicsapódásával vagy koagulációjával; definíciónk egy kicsit szélesebb.,) Sokféle reagens és körülmény, például hő, szerves vegyületek, pH-változások és nehézfémionok fehérje denaturációt okozhatnak.
|
Method |
Effect on Protein Structure |
|---|---|
|
Heat above 50°C or ultraviolet (UV) radiation |
Heat or UV radiation supplies kinetic energy to protein molecules, causing their atoms to vibrate more rapidly and disrupting relatively weak hydrogen bonding and dispersion forces., |
|
szerves vegyületek, mint például etil-alkohol |
Ezek a vegyületek képesek munkavégzésre intermolecular hidrogén-kötés a fehérje molekulák, megzavarja így a hidrogén kötés belül a fehérje., |
|
Sók a nehézfém-ionok, mint például a higany, ezüst, valamint a vezető |
Ezek az ionok formájában erős kötelék a karboxilát anion a savas aminosavak, vagy SH csoportok cisztein, megzavarja ionos kötés, valamint a diszulfid kapcsolatok. |
|
Alkaloid reagensek, mint a csersav (használt barnító bőr) |
Ezek a reagensek össze a pozitív töltésű aminosav csoportokban a fehérjék, hogy megzavarják ionos kötés., |
bárki, aki tojást sütött, megfigyelte a denaturációt. A tiszta tojásfehérje átlátszatlanná válik, ahogy az albumin denaturálódik és koagulálódik. Még senki sem fordította meg ezt a folyamatot. A megfelelő körülmények és elegendő idő miatt azonban egy kellően szelíd körülmények között kibontakozó fehérje újra feltöltődhet, és ismét biológiai aktivitást mutathat (2.5.1.ábra). Ezek a bizonyítékok arra utalnak, hogy legalább ezen fehérjék esetében az elsődleges szerkezet határozza meg a másodlagos és a tercier szerkezetet., Úgy tűnik, hogy egy adott aminosav-szekvencia természetesen elfogadja annak háromdimenziós (3D) elrendezését, ha a feltételek megfelelőek.
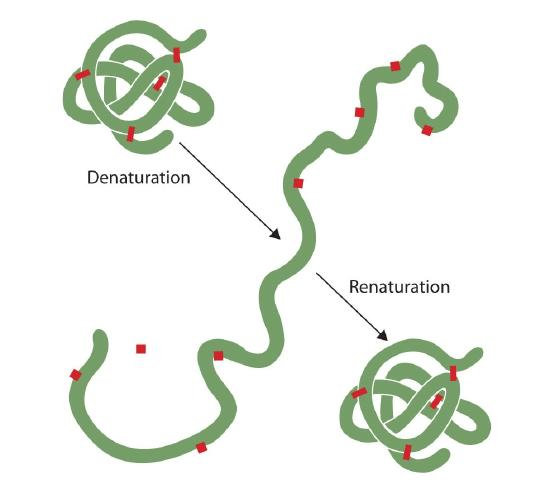
a fehérjék elsődleges szerkezete meglehetősen erős., Általában meglehetősen erőteljes feltételekre van szükség a peptidkötések hidrolizálásához. A másodlagos kvaterner szinteken azonban a fehérjék nagyon érzékenyek a támadásra, bár a denaturációval szembeni sebezhetőségükben különböznek. A finoman hajtogatott gömbölyű fehérjéket sokkal könnyebb denaturálni, mint a haj és a bőr kemény, rostos fehérjéit.
összefoglaló
a fehérjék két kategóriába sorolhatók: rostosak, amelyek vízben oldhatatlanok, és globulárisak, amelyek vízben jobban oldódnak. A fehérje legfeljebb négy szintű szerkezetű lehet., Az elsődleges szerkezet a specifikus aminosav-szekvenciából áll. A kapott peptidlánc α-helixet vagy β-redős lapot képezhet (vagy a helyi struktúrák nem olyan könnyen kategorizálhatók), amelyet másodlagos szerkezetnek neveznek. A szekunder szerkezet ezen szegmensei beépülnek a hajtogatott polipeptidlánc harmadlagos szerkezetébe. A kvaterner szerkezet leírja az alegységek elrendezését egy olyan proteinben, amely egynél több alegységet tartalmaz., A vonzó kölcsönhatások négy fő típusa határozza meg a hajtogatott fehérje alakját és stabilitását: Ionos kötődés, hidrogénkötés, diszulfid kapcsolódások és diszperziós erők. A reagensek és állapotok széles választéka miatt a fehérje kibontakozhat vagy denaturálódhat.