Johdanto
Lipaasi katalysoi jakautuminen lipidien, jonka hydrolysoimaan, että rasvahappojen. Sen tehtävä on tärkeä ruoansulatukselle ja rasvojen imeytymisen edistämiselle suolistossa. Lipaasia esiintyy pääasiassa haimassa ja erittää sitä, mutta sitä esiintyy myös syljessä ja vatsassa.
- Haiman lipaasi (PDB ID: 1hpl), joka on kuvassa oikealla, on karboksyylihappojen esteri hydrolaasi. Sitä kutsutaan myös yleisesti haiman triasyyliglyserolilipaasiksi ja sen entsyymiluokkaluku on E. C. 3.1.1.3 .,
- sappisuola-stimuloitua lipaasia (BSSL) on rintamaidossa.
- hormoniherkkä lipaasi (LIPE) hydrolysoi erilaisia estereitä. Lisätietoja Hormoni herkkä lipaasi.
- Monoasyyliglyserolilipaasi (MAGL) hydrolysoi solunsisäiset triglyseridit rasvahapoksi ja glyseroliksi. MAGL toimii yhdessä Lipen kanssa. Katso lisätietoja Monoglyseridilipaasista.
entsyymin katalysoima reaktio on esitetty alla.
tarkempi erittely johtaa lopulta 2-monoacylglycerols ja vapaita rasvahappoja ., Mekanismia käsitellään perusteellisesti lipaasin katalyyttisen mekanismin osassa. Lipaasin rakenteen ja toiminnan määrittäminen oli asteittainen prosessi. Lipaasiaktiivisuuden osoitti haimassa ensimmäisen kerran Claude Bernard vuonna 1846. Mattson ja Beck osoittivat kuitenkin vasta vuonna 1955 haimalipaasin korkean spesifisyyden triglyseridien primaariestereille . Viime vuosina määrittäminen crystal rakenne haiman lipaasi on tullut ensisijainen painopiste, koska monet tutkijat ovat työskennelleet edelleen tämä.,
Katso myös
- Molekyyli Leikkipaikka/Haiman Lipaasi
- Lipaasi kannella morph
- Hormoni herkkä lipaasi
- Lipaasi Candida antarctica suljetussa tilassa
- Monoglyceride lipaasi
- Ihmisen maha lipaasi
- Lipaasi (heprea)
- Rasva-aineenvaihduntaa
Rakenne
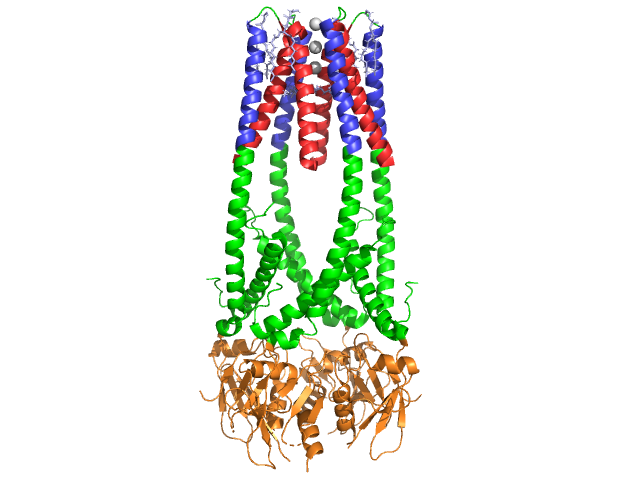
Haiman lipaasi on 50 kDa proteiini., Kun crystallographic epäsymmetrinen yksikkö sisältää kaksi samanlaista ketjut, tiedot (HUOMAUTUS 350) tiedoston 1hpl osoittaa, että dimeeri on kiteytys artefakti, ja että toiminnallinen muoto (kutsutaan myös biologinen kokoonpano) on yksi ketju (monomeeri). Ketju koostuu 449 tähteestä . S lipaasia (yksi alayksikkö) kuuluu 102 jäämiä, jotka luovat 13 alfa-heliksejä, punaisella, ja 139 jäämiä mukana beta-levyt yhteensä 28 säikeet, näkyy kultaa. Alfa-helieettien osuus proteiinista on 22 prosenttia, kun taas beta-arkkien osuus on 30 prosenttia., Jokainen ketju sisältää kaksi hyvin määriteltyä . Sinisessä n-terminaalisessa domeenissa on ominaista alfa – / beeta-hydrolaasikertymä. Kun taas C-terminaali domain, näkyy vihreä, sisältää beta arkki sandwich joka vuorovaikutuksessa colipase . Lipaasin jokaista monomeeria ja dimeerirakennetta pitävät koossa disulfidisidokset, vetysidokset ja sähköstaattiset vuorovaikutukset (suolasillat). Lipaasissa on yhteensä 12 kysteiinijäämää. on muodostettu myönteisesti vastaa nitrogens (sininen) ja Lys Arg, ja negatiivinen oxygens (punainen) Asp ja Glu jäämiä., (keltaisena) stabiloi entsyymiä myös pääketjun ja sivuketjuatomien välillä. Lipaasilla on selvä jakauma jäämiä (violetti spacefill edustaa polaarisia jäämiä). Hydrofobinen romahdus vaikuttaa paljon toisen ja kolmannen asteen rakenteita, kuten (kuvassa valkoinen) muodostavat sisätilojen proteiinia, kun taas polar jäännökset (läpinäkyvä sininen) ovat pinnalla . Lisäksi lipasella on kaksi . Yksi on haudattu jokaiseen monomeerin alayksikköön. Kalsiumioni on välttämätön proteiinin taittelun ja entsyymiaktiivisuuden kannalta ., Kuvassa vihreä kalsium-ioni-alayksikkö On, koordinoi Glu187, Arg190, Asp192, ja Asp195 jäämiä. Ca(+2) maksu on vakiintunut negatiivisesti varautuneita glutamaatti ja aspartaatti jäämiä, ja happi atomien kaksi vesimolekyylit (vaaleanpunainen).
lisäksi, lipaasi on ainutlaatuinen (vihreä), joka estää liuottimen pääsyn aktiivisen (punainen). Kansi on 25-jäämäinen kierteinen rakenne, joka suojaa oksianionireikää., Kansi (keltainen) on erityisen tärkeää substraatin sitova, sillä se käy läpi dramaattinen muutos, joka muuttaa toissijainen rakenne lipaasi sitova sivuston (aktiivisen punainen) on (aktiivinen sivusto, sininen, triacylglyceride vuonna spacefill) (ks Lipaasi kannella morph, että animaatio siirtyminen). Kannen avaaminen on mukana muutos toisen asteen rakenne-enimmäkseen beta-laajennettu vahvistus rakenne, jossa yli puolet aktiivinen sivusto on muodostettu alfa-heliksejä .,
Colipase Koentsyymi
Lipaasi aktivoituu colipase, koentsyymi, joka sitoutuu C-terminaali, ei-katalyyttinen verkkotunnuksen lipaasi. Kolipaasi on 10kda-proteiini, jota haima erittää inaktiivisessa muodossa. Se on viisi säilytetty (kuvassa keltainen) , ja 2 – hydrofiilinen pinta (sivusto lipaasi C-terminaali vuorovaikutus – kuvassa sininen) ja hydrofobinen pinta (sisältää useita hydrofobisia silmukoita silta rasva – kuvassa valkoinen). Trypsiini aktivoi kolipaasin ennen kuin kofaktori voi olla vuorovaikutuksessa lipaasin kanssa.,
Kolipaasin on oltava läsnä lipaasin aktivoinnissa ja se toimii siltana lipaasin ja lipidin välillä. Kolipaasin sitoutuessa aktiivinen lipaasi stabiloituu hydrofobiseen vuorovaikutukseen triasyyliglyseridien kanssa . Ilman colipase hetkellä kertyminen amphiphiles öljy/vesi-rajapinnan pohjukaissuolen estää haiman lipaasi sitoutumisen sen alustan. . Kolipaasi ja lipaasi ovat vastapäätä aktiivista kohtaa C-terminaalissa (kontaktit ovat vaaleanpunaisia ja keltaisia alueita, joissa vesimolekyylit näkyvät tummansinisinä). Entsyymit sitoutuvat polaarisiin vuorovaikutuksiin, kuten ja .,
läsnäollessa colipase, entsyymi aktivoituu joka liikkuu (näkyy punainen, aktiivisen vihreä), joka koostuu aminohapoista 216-239. N-terminaalinen läppä liikkuu koordinoidusti yhdessä C-terminal domain paljastaa aktiivisen (vihreä), jolloin se sitoo substraatin kanssa. On arveltu, että tämä joustavuus voi olla merkitystä sitova colipase-lipaasi monimutkainen vesi-rasva-käyttöliittymä. Läpän uudelleenjärjestely aiheuttaa myös toisen konformaatiomuutoksen, joka luo oksianionireiän.,
Lipaasi Katalyyttinen Mekanismi
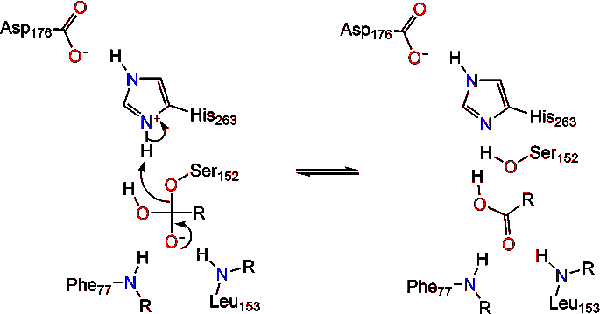
Lipaasi aktivointi rasva-vesi rajapinta triacylglycerides, läsnäollessa colipase ja sappi suolat tunnetaan rajapinta aktivointi. Sillä hydroloysis reaktio tapahtua, colipase ankkurit lipaasi, että rasva-vesi-kalvo misellin, joka aiheuttaa pinnan muutos lipaasi. Kolipaasin neljä hydrofobista silmukkaa vuorovaikuttavat triasyyliglyseridin hydrofobisen ilmakehän kanssa. Tämä käynnistää aktiivisen sitova rasva, ja kannen avaaminen paljastaa enemmän hydrofobinen ympäristö asemassa., Tämä puolestaan mahdollistaa triasyyliglyserolin vuorovaikutuksessa keskeisten aktiivisten sivuston jäämien kuten katalyyttinen triadi. Erilaisia lipaasientsyymejä löytyy luonnosta. Vaikka eri muodoissa miehittää monipuolinen proteiini kehikko-ja tukimateriaalit, useimmat ovat rakennettu alfa – /beta-hydrolaasi kertaiseksi ja hallussaan kymotrypsiini-kuten koostuu happamia jäämiä, histidiini, ja seriini nucleophile. Hevosen haimalipaasin tapauksessa katalyyttinen triadi koostuu . Tämä katalyyttinen triadi toimii kuten useimmat luonnossa., Ensimmäinen, asparagiinihappo muodostaa vetysidos Hänen 263, lisäämällä pKa histidiini imidatsoli typpeä. Tällöin histidiini voi toimia voimakkaana yleisenä tukikohtana ja deprotonoida seriinin. Se deprotonated seriini sitten voi toimia nukleofiilinä ja hyökkäys esteri karbonyyli yksi rasvahappoja 1-tai 3 hiiliatomia ja glyseroli selkäranka rasva-alustaan. Hyökätessään lipidiin muodostuu negatiivisesti varautunut tetraedrinen Välituote (reaktio 1). Sitä stabiloidaan oksianioniaukkoon kahdella jäämällä:.,
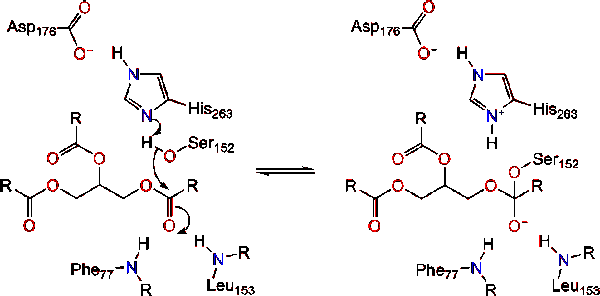
karbonyyli uudistuksia glyseroli selkäranka segmentti toimii lähtevä ryhmä (Reaktio 2).
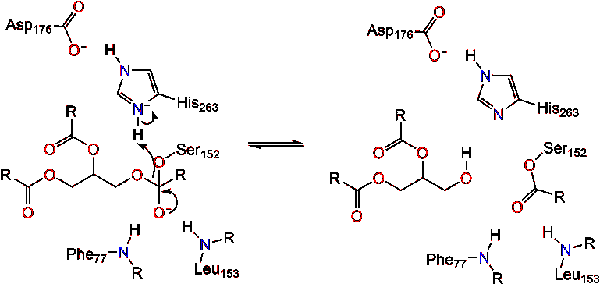
vesimolekyyli sitten lahjoittaa protonin, että histidiini, luoda reaktiivisia hydroksyyli-anioni. Hydroksyyli-anioni voi sitten hyökätä karbonyyli carbon lipidien, jotka muodostavat toisen negatiivisesti varautuneita tetraedrisen välituotteen, joka on vakiintunut oxyanion reikä (Reaktio 3).,
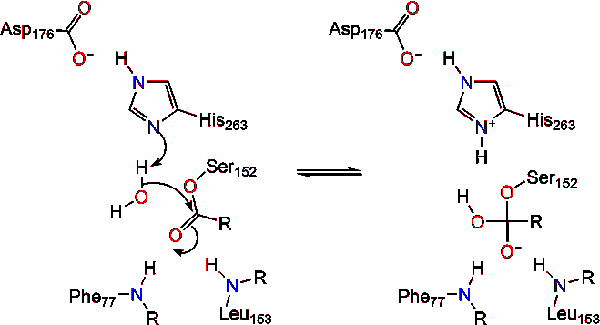
Kun uskonpuhdistuksen karbonyyli, katalyyttinen seriini vapautuu ja monoglyceride ja rasvahappojen monomeerit hajanainen pois (Reaktio 4).
Esto Haiman Lipaasi
(violetti), a C11-alkyyli fosfonaatti, on kilpailukykyinen estäjä haiman lipaasi. Se sitoutuu suoraan aktiivisen sivuston taskuun. Lipaasiin liittyy myös viisi B-oktyyliglukosidia (harmaata ja punaista) molekyyliä., MUP muodostaa vetysidokset : Ser 152 ja Hänen 263, jotka ovat osa katalyyttinen kolmikko, ja Phe 77 ja Leu 153 jotka ovat vakiintumassa jäännökset sijaitsevat oxyanion reikä .MUP osoitettiin olevan van der Waalsin yhteyksiä hydrofobinen puolella ketjut Ala 178, Phe 215, Pro l80, Tyr ll4, Leu 213 (kuvassa sininen).
Proteiinisubstraattien interaktiot
lipaasi sitoutuu lukuisiin hydrofobisiin kontakteihin. Kuten tässä näkyy, lipaasi vaikuttaa kolesteryylilinoleaatin alkyyliryhmään hydrofobisen repeämän kautta proteiinin sisällä., Tämä repeämä ohjaa molekyylin optimoimaan lipolyysireaktion.
tässä kohtauksessa on lipaasi hiivasta Candida rugosa, jossa on kaksi molekyyliä kolesteryylilinoleaattia (harmaa). Aktiivisen jäämät mukaan lukien Ser152, Asp176, ja His263 näkyvät punaisella kiinni edustus. Lipaasiin mahtuu kaksi lipidimolekyyliä, koska kaksi identtistä alayksikköä katalysoivat identtistä reaktiota. Yksi lipaasimolekyyli voi katalysoida kahta lipolyysireaktiota kerrallaan.,
Kliininen Merkitys
Haiman lipaasi erittyy pohjukaissuoleen kautta kanavistoon haima. Terveellä ihmisellä sen pitoisuus seerumissa on hyvin pieni. Äärimmäisissä häiriöitä haiman toiminnan, kuten haimatulehdus tai haimasyöpä, haiman voi alkaa sulattaa itse ja vapautumista haiman entsyymit mukaan lukien haiman lipaasi osaksi seerumin. Seerumin haiman lipaasipitoisuuden mittaaminen voi siis auttaa akuutin haimatulehduksen diagnosoinnissa.., Koska lipaasi toimintaa, ruoansulatusta ja imeytymistä rasvaa, on ollut kasvava markkina lipaasi-estäjät laihtuminen lääkkeitä. Suosituin on Orlistaatti (tai Xenical®), joka on luonnollinen tuote peräisin Streptomyces toxytricini ja on hydraus tuote lipostation – peruuttamaton lipaasi estäjä. Tämä estäjä toimii myös sitomalla Ser152, tuottaa esteri, joka hydrolysoi niin hidas, että se on käytännössä peruuttamaton .
3D-Rakenteet Lipaasi
Lipaasi 3D-Rakenteet