Kaliumia rikkivetyä edustaa kemiallinen kaava K2S on yhdiste, kaliumia ja rikkiä, joka on kohtalaisen liukenee happoihin . Se hourailee ja saattaa syttyä itsestään palamaan ilmassa. Se on pelkistävä aine ja ioniyhdiste .

Kaliumia Rikkivetyä
Koostumus ja Synteesi
Kaliumia rikkivetyä voidaan valmistaa ensimmäinen hoitoon kaliumhydroksidi liikaa rikkivetyä muodostaa kaliumia hydrosulfide (KHS)., KHS: n jatkohoito samalla määrällä kaliumhydroksidia tuottaa kaliumsulfidia .,H2S = KHS + H2O
KHS + KOH = K2S + H2O

Potassium Sulfide Formula
Properties and Characteristics of Potassium Sulfide
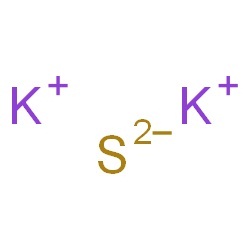
Potassium Sulfide Structure
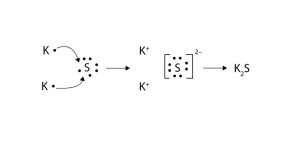
Lewis Dot Structure for Potassium Sulfide
Prominent Reactions of K2S
Potassium sulfide reacts with cobalt iii bromide to produce cobalt iii sulfide and potassium bromide .,
3K2S + 2CoBr3 = Co2S3 + 6KBr
Kaliumia sulfidi reagoi laimennettua suolahappoa tuottaa kaliumkloridia ja rikkivetyä .
K2S + 2HCl = 2 KCl + H2S
Se reagoi väkevän rikkihapon kanssa antaa kaliumia bisulfate, rikkidioksidin, rikin ja vettä
K2S + 3H2SO4 = 2KHSO4 + SO2 + S + 2H20
yhdiste reagoi hopea nitraatti muodostaa vesiliuoksen kaliumnitraattia ja hopea rikkivetyä sakka .
K2S + 2AgNO3 = 2KNO3 + Ag2S
Kaliumia Rikkivetyä Käyttää
- pyrotekniikkaa .
- reagenssina analyyttisessä kemiassa .,
- depilatoriona ja lääkkeenä .
Onko Se Vaarallista
Se voi aiheuttaa palovaaran, joten on otettava huomioon varotoimenpiteet, ei tuoda sen kosketuksiin ilman kanssa. Jauheena tai pölynä se on räjähtävää. Nieleminen, hengittäminen ja ihokosketus voivat aiheuttaa vakavia vammoja ja jopa kuoleman. Se vaikuttaa myös vahingollisesti silmiin ja ihoon aiheuttaen silmävaurioita ja ihon palovammoja. Siksi kaikkea kosketusta tulee välttää. Se aiheuttaa myrkyllisiä kaasuja, jos se kuumennetaan hajoamiseen . Se on luonteeltaan syövyttävä ja ympäristölle myrkyllinen .
- Kaliumsulfidi – Amerikanelementit.,com
- Kaliumia Sulfida – Chemspider.com
- Kaliumia Sulfida – Pubchem.ncbi.nlm.nih.gov
- Kaliumia Sulfida – Chemicalbook.com
- Se K2S happamia tai emäksisiä? – Quora.com
- Dikaliumsulfida – Webelements.com
- mitkä ovat kaliumsulfidan käyttötarkoitukset? – Quora.com
- Kaliumia Sulfida – Merckmillipore.com
- Valmistelu kaliumia sulfida – Prepchem.com
- Liukoisuus Säännöt ja Net Ionic Yhtälöt Käytäntö – Vincentianacademy.org
- Kaliumia sulfida reagoida kloorivety – Chemiday.,com
- Question #e42f1 – Socratic.org
- Potassium sulfide react with sulfuric acid – Chemiday.com