Osmoosi
Kuvittele nyt, että sinulla on toinen kuppi, jossa \(100 \: \text{mL}\) vettä, ja voit lisätä \(45 \: \text{g}\) taulukon sokeria vettä. Aivan kuten ensimmäinen kuppi, sokeri on liuotin, ja vesi on liuotin. Mutta nyt sinulla on kaksi sekoitusta eri solute pitoisuudet. Verrattaessa kahta ratkaisut eriarvoiseen liuenneen aineen pitoisuus, liuoksen kanssa korkeampi liuenneen aineen pitoisuus on hypertoninen, ja ratkaisu alentaa liuenneen aineen pitoisuus on hypotoninen., Tasasuuruiset liuokset ovat isotonisia. Ensimmäinen sokeriliuos on hypotoninen toiseen liuokseen. Toinen sokeriliuos on hypertoninen ensimmäiseen.
Voit nyt lisätä kaksi ratkaisuja dekantterilasiin, joka on ollut jaettuna puoliläpäisevä kalvo, jossa on huokosia, jotka ovat liian pieniä, jotta sokeri molekyylejä läpi, mutta ovat tarpeeksi vettä molekyylejä läpi. Hypertoninen liuos on kalvon toinen puoli ja hypotoninen liuos toinen., Hypertonisen liuoksen vesipitoisuus on pienempi kuin hypotonisen liuoksen, joten veden pitoisuusgradientti on nyt olemassa kalvon poikki. Vesimolekyylit siirtyvät korkeamman vesipitoisuuden puolelta alemman pitoisuuden puolelle, kunnes molemmat liuokset ovat isotonisia. Tässä vaiheessa saavutetaan tasapaino.
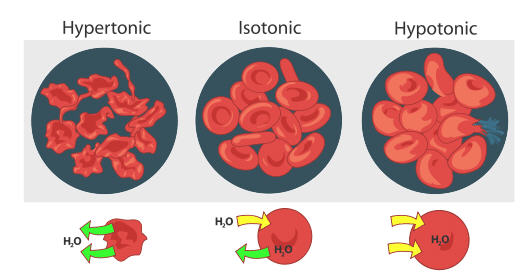
punasolut käyttäytyvät samalla tavalla (ks.kuva alla). Kun punasoluja on hypertoninen (korkea pitoisuus) ratkaisu, vesi virtaa ulos solusta nopeammin kuin se tulee. Tämä johtaa verisolujen krenatoitumiseen (kutistumiseen)., Toisessa ääripäässä hypotoninen punasolu (pienempi pitoisuus solun ulkopuolella) johtaa siihen, että soluun virtaa enemmän vettä kuin ulos. Tämä johtaa turvotus solujen ja mahdollinen hemolyysi (tupaten) solun. Isotonisessa liuoksessa veden virtaus soluun ja ulos tapahtuu samaa tahtia.
Osmoosi on diffuusiota vesimolekyylien koko puoliläpäisevä kalvo pinta-ala on pienempi pitoisuus ratkaisu (eli korkeampi pitoisuus vesi) alue, jonka pitoisuus on suurempi ratkaisu (eli pienempi pitoisuus vedessä). Vesi siirtyy soluihin ja ulos osmoosilla.
- Jos solu on hypertoninen ratkaisu, ratkaisu on alentaa veden pitoisuus kuin solun sytosolissa, ja vesi liikkuu ulos solusta, kunnes molemmat ratkaisut ovat isotoninen.,
- Solut sijoitetaan hypotoninen liuos tulee ottaa vettä koko niiden kalvot, kunnes molemmat ulkoinen ratkaisu ja sytosolissa on isotoninen.
punasolujen turvota ja tehdään hemolyysi (burst) kun sijoitetaan hypotoninen liuos. Kun punasolu asetetaan hypertoniseen liuokseen, se menettää vettä ja kokee krenaation (shrivel). Eläinten solujen taipumus tehdä parhaiten isotonisella ympäristössä, jossa veden virtaus sisään ja ulos solusta tapahtuu yhtä hinnat.