erittäin järjestäytynyttä rakenteiden proteiineja ovat todella mestariteoksia kemiallisten arkkitehtuuri. Mutta hyvin järjestäytyneillä rakenteilla on yleensä tiettyä herkkua, ja tämä pätee proteiineihin. Denaturointi on termi, jota käytetään muutoksista kolmiulotteinen rakenne, proteiini, joka tekee se pysty suorittamaan sen määritetty toiminto. Denaturoitu proteiini ei voi tehdä työtään. (Joskus denaturaatio rinnastetaan proteiinin saostumiseen tai hyytymiseen; määritelmämme on hieman laajempi.,) Monenlaiset reagenssit ja olosuhteet, kuten lämpö, orgaaniset yhdisteet, pH: n muutokset ja raskasmetalli-ionit voivat aiheuttaa proteiinin denaturaation.
|
Method |
Effect on Protein Structure |
|---|---|
|
Heat above 50°C or ultraviolet (UV) radiation |
Heat or UV radiation supplies kinetic energy to protein molecules, causing their atoms to vibrate more rapidly and disrupting relatively weak hydrogen bonding and dispersion forces., |
|
Käytä orgaanisia yhdisteitä, kuten etyylialkoholia, |
Nämä yhdisteet pystyvät harjoittaa molekyylien välisten vety liimaus proteiini-molekyylejä, häiritsevät molekyylin sisäiset vetysidokset sisällä proteiinia., |
|
Suolat raskas metalli-ioneja, kuten elohopeaa, hopeaa ja lyijyä |
Nämä ionit muodostavat vahvoja siteitä karboksylaatti anionit happamassa aminohappoja tai SH-ryhmien kysteiini, häiritsevät ionic joukkovelkakirjojen ja disulfidi yhteyksiä. |
|
Alkaloidi reagenssit, kuten parkkihappo (käytetään rusketuksen nahkaa) |
Nämä reagenssit yhdistää positiivisesti varautuneita aminohappoja ryhmien proteiineja häiritä ionisidoksia., |
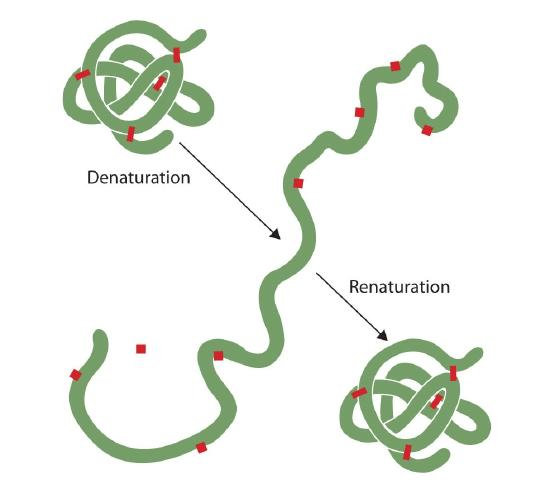
Jokainen, joka on paistettu muna on havaittu denaturointi. Kirkas munanvalkuainen muuttuu läpinäkymättömäksi, kun albumiini denaturoituu ja hyytyy. Kukaan ei ole vielä peruuttanut tätä prosessia. Kuitenkin, kun otetaan huomioon asianmukainen olosuhteet ja riittävästi aikaa, proteiini, joka on avattuna riittävän lempeä ehtoja voi uudelleen taitella ja voi taas ilmetä biologista aktiivisuutta (Kuva 2.5.1). Tällainen näyttö viittaa siihen, että ainakin näiden proteiinien osalta perusrakenne määrittää sekundäärisen ja tertiäärisen rakenteen., Tietyn sekvenssin aminohappoja tuntuu hyväksyä sen erityisesti kolmiulotteinen (3D) järjestely luonnollisesti, jos olosuhteet ovat oikeat.
ensisijainen rakenteiden proteiineja ovat melko tukeva., Yleensä peptidisidosten hydrolysoimiseen tarvitaan melko voimakkaita olosuhteita. Keskiasteen kautta kvaternaariset tasoa, kuitenkin, proteiinit ovat varsin alttiita hyökkäys, vaikka ne vaihtelevat niiden haavoittuvuutta denaturointi. Hienovaraisesti Taitetut globulaariproteiinit ovat paljon helpompia denaturoida kuin hiusten ja ihon sitkeät, kuitumaiset proteiinit.
Tiivistelmä
Proteiinit voidaan jakaa kahteen ryhmään: kuitu, joka yleensä liukene veteen, ja pallomainen, jotka ovat vesiliukoisia. Proteiinissa voi olla jopa neljä rakennetta., Perusrakenne koostuu spesifisestä aminohapposekvenssistä. Tuloksena peptidi ketjun voi muodostaa α-helix-tai β-taitetun arkin (tai paikalliset rakenteet ole yhtä helppo luokitella), joka tunnetaan toissijainen rakenne. Nämä toisiorakenteen segmentit sisällytetään Taitetun polypeptidiketjun tertiäärirakenteeseen. Kvaternaarinen rakenne kuvaa alayksikköjen järjestelyjä proteiinissa, joka sisältää useamman kuin yhden alayksikön., Neljä suurta tyyppisiä houkutteleva vuorovaikutus määrittää muodon ja vakautta taitettu proteiinia: ionisidos, vety liimaus, disulfidi-yhteyksiä, ja hajonta voimia. Monenlaiset reagenssit ja olosuhteet voivat saada proteiinin avautumaan tai denaturoitumaan.