varme og temperatur er et nært beslægtet emne, og som sådan kan forskellen mellem de to være lidt forvirrende. Kerneforskellen er, at varme beskæftiger sig med termisk energi, mens temperaturen er mere optaget af molekylær kinetisk energi.
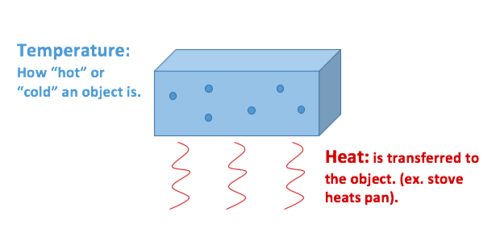
varme er overførsel af termisk energi, hvorimod temperatur er en egenskab objektet udviser.
Hvad er forskellen?,
varme beskriver overførslen af termisk energi mellem molekyler i et system og måles i Joule. Varme måler, hvordan energi bevæger sig eller strømmer. Et objekt kan få varme eller miste varme, men det kan ikke have Varme. Varme er et mål for forandring, aldrig en ejendom besat af en genstand eller et system. Derfor er det klassificeret som en procesvariabel.
temperatur beskriver den gennemsnitlige kinetiske energi af molekyler i et materiale eller system og måles i Celsius (C C), Kelvin(K), Fahrenheit (F F) eller Rankin (R)., Det er en målbar fysisk egenskab af et objekt—også kendt som en statsvariabel. Andre målbare fysiske egenskaber omfatter hastighed, masse og tæthed, for at nævne nogle få.
ligheder
varme er en overførsel af termisk energi forårsaget af en temperaturforskel mellem molekyler.
Bemærk:
termisk energi kan ellers forstås som den samlede mikroskopiske kinetiske og potentielle energi i et system.,
den Anden Lov om Termodynamik
Den anden lov om termodynamik er et komplekst emne, der kræver intensiv undersøgelse inden for termodynamik, for virkelig at forstå. Men med henblik på denne artikel skal kun et lille aspekt forstås, og det er det faktum, at varme altid vil strømme spontant fra varmere stoffer til koldere stoffer. Denne enkle erklæring forklarer, hvorfor en isterning ikke dannes udenfor på en varm dag, eller hvorfor den smelter, når den falder i en skål varmt vand.,
tankeeksperiment
Forestil dig, at den førnævnte isterning faldt i en skål varmt vand—isen skal få varme (termisk energi) fra vandet i skålen (se foregående afsnit). Tilsætning af termisk energi fører til en stigning i ismolekylets kinetiske energi og dermed en stigning i temperaturen. Dette er kendt, fordi temperaturen faktisk er målet for molekylernes gennemsnitlige kinetiske energi. Desuden vil isen fortsætte med at få termisk energi, hvilket får dens molekyler til at bevæge sig hurtigere og til sidst bryde deres intermolekylære bindinger eller smelte.,
Afslutningsvis vil overførslen af varme eller termisk energi typisk ændre stoffets temperatur, men ikke altid! For eksempel, i det øjeblik, hvor isen i skålen bliver til vand, vil disse vandmolekyler være på nøjagtig samme temperatur som da de var is. I dette tilfælde fungerer det i stedet for den termiske energi, der arbejder for at øge den kinetiske energi, at bryde de intermolekylære bindinger og forårsage en tilstandsændring., Imidlertid, som tiden går, vil temperaturen på den nyligt smeltede is stige, indtil alt inden i skålen når ligevægt—hvilket betyder en konsistent temperatur overalt.
For Yderligere Læsning
- Varme
- Temperatur
- Termisk energi
- Kinetisk energi
- Indre energi
- Eller udforske en tilfældig side