introduktion
Lipase katalyserer nedbrydningen af lipider ved hydrolysering af estere af fedtsyrer. Dens funktion er vigtig for fordøjelsen og fremme absorption af fedtstoffer i tarmene. Lipase findes primært i og udskilles af bugspytkirtlen, men findes også i spyt og mave.
- pancreaslipase (PDB ID: 1hpl), som er afbildet til højre, er en Carbo .ylesterhydrolase. Det er også almindeligt kaldet pancreas triacylglycerol lipase og dens en .ym klasse nummer er E. C. 3.1.1.3 .,
- den galdesaltstimulerede lipase (BSSL) findes i modermælk.
- den hormonfølsomme lipase (LIPE) hydrolyserer en række estere. For detaljer se hormonfølsom lipase.
- Monoacylglycerollipase (MAGL) hydrolyserer intracellulære triglycerider til fedtsyre og glycerol. MAGL fungerer sammen med LIPE. For detaljer se Monoglycerid lipase.
reaktionen katalyseret af en .ymet er vist nedenfor.
yderligere nedbrydning resulterer i sidste ende i 2-monoacylglyceroler og frie fedtsyrer ., En dybdegående diskussion af mekanismen findes i Lipase katalytisk Mekanismesektion. Bestemmelsen af lipases struktur og funktion var en gradvis proces. Lipase aktivitet blev først demonstreret i bugspytkirtlen af Claude Bernard i 1846. Det var imidlertid først i 1955, at Mattson og Beck demonstrerede en høj specificitet af pancreas lipase for triglycerid primære estere . I de senere år er bestemmelse af krystalstrukturen i bugspytkirtellipase blevet det primære fokus, da mange forskere har arbejdet for at fremme dette.,
Se også
- Molekylær Legeplads/Pancreas Lipase
- Lipase låg morph
- Hormon-følsomme lipase
- Lipase fra Candida antarktis i lukket tilstand
- Monoglyceride lipase
- Human gastrisk lipase.
- Lipase (hebraisk)
- Lipid metabolisme
Struktur
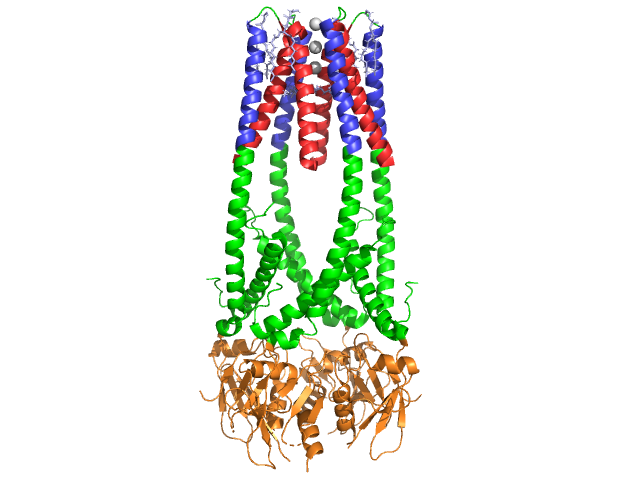
Pancreas lipase er en 50 kDa protein., Mens krystallografiske asymmetrisk enhed indeholder to identiske kæder, information (BEMÆRKNING 350) i datafilen 1hpl angiver, at dimer er en krystallisering artefakt, og at den funktionelle form (også kaldet den biologiske samling) er en enkelt kæde (monomer). Kæden består af 449 rester . S af lipase (i en underenhed) omfatter 102 rester, der skaber 13 alfa helices, vist i rødt, og 139 rester involveret i beta ark i alt 28 tråde, vist i guld. Alfa-spiralerne tegner sig for 22% af proteinet, mens beta-arkene udgør 30%., Hver kæde indeholder to veldefinerede . Det N-terminale domæne, der er vist i blåt, er kendetegnet ved en alfa/beta-hydrolasefold. Mens C terminal domænet, vist i grønt, indeholder en beta sheet sand .ich, der interagerer med colipase . Hver monomer og dimerstruktur af lipase holdes sammen af disulfidbindinger, hydrogenbindinger og elektrostatiske interaktioner (saltbroer). Lipase har 12 total mellem cysteinrester. dannes mellem positivt ladede nitrogener (blå) i Arg og Lys, og negative o .ygener (rød) i ASP og limrester., en .ymet mellem hovedkæden og sidekædeatomer. Lipase har en tydelig fordeling af rester (lilla spacefill repræsenterer polære rester). Hydrofob sammenbrud bidrager til meget af de sekundære og tertiære strukturer, da (vist i hvidt) udgør det indre af proteinet, mens polære rester (gennemsigtig blå) er på overfladen . Derudover har lipase to . Den ene er begravet i hver monomer-underenhed. Calciumion er afgørende for proteinfoldning og en .ymaktivitet ., Billedet viser den grønne calciumion i underenhed A, koordineret af Glu187, Arg190, Asp192 og Asp195 rester. Ca (+2) ladningen stabiliseres af negativt ladede glutamat-og aspartatrester og O .ygenatomer fra to vandmolekyler (pink).
derudover har lipase en unik (grøn), der blokerer opløsningsmiddel fra at komme ind på det aktive sted (rødt). Låget er en 25-rest spiralformet struktur, der beskytter o .yanionhullet., Låget (gul) er især vigtigt, at underlaget er bindende, som den undergår en dramatisk forandring, der ændrer den sekundære struktur af lipase bindende websted fra en (aktive site i rød) til en (aktive site i blå, triacylglyceride i spacefill) (se Lipase låg morph for en animation af denne overgang). Lågåbningen ledsages af en ændring i sekundær struktur fra en for det meste beta-udvidet bekræftelse til en struktur, hvor mere end halvdelen af det aktive sted er dannet af alfa-helices .,
Colipase Coenzym
Lipase er aktiveret, ved at colipase, en coenzym, der binder til den C-terminale, ikke-katalytiske domæne af lipase. Colipase er en 10ketprotein, der udskilles af bugspytkirtlen i en inaktiv form. Det har fem bevares (vist med gult) , og 2 – en hydrofil overflade (site af lipase C-terminal interaktion – vist med blåt) og hydrofobe overflade (indeholder flere hydrofobe sløjfer til broen lipid – vist i hvid). Trypsin aktiverer derefter colipase, før cofaktoren kan interagere med lipase.,
Colipase skal være til stede for aktivering af lipase og fungerer som en bro mellem lipase og lipid. Når colipase binder, stabiliseres aktiv lipase for den hydrofobe interaktion med triacylglycerider . Uden colipase til stede ville akkumuleringen af amfifiler ved olie/vand-grænsefladen i tolvfingertarmen forhindre pancreas lipase i at binde til dets substrat. . Colipase og lipase er modsatte af det aktive sted på C-terminalen (kontakter er områder med lyserød og gul, med vandmolekyler vist i mørkere blå). En .ymerne er bundet af polære interaktioner såsom, og.,
i nærvær af colipase aktiveres en .ymet, der bevæger det (vist i rødt, aktivt sted i grønt), der er sammensat af aminosyrer 216-239. N-terminalklappen bevæger sig på en samordnet måde sammen med C-terminaldomænet for at afsløre det aktive sted (grønt), så det kan binde med et substrat. Det antages, at denne fleksibilitet kan have betydning for binding af colipase-lipase-komplekset med vand-lipid-grænsefladen. Omorganiseringen af klappen inducerer også en anden konformationsændring, der skaber o .yanionhullet.,
Lipase Katalytisk Mekanisme
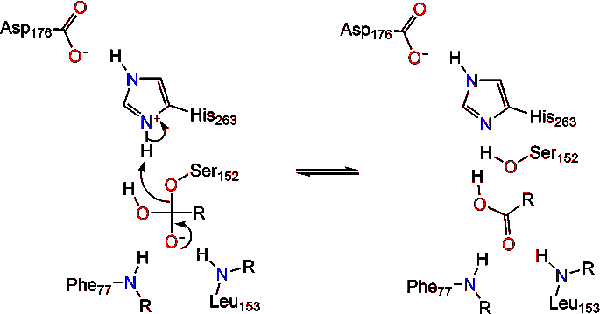
Lipase aktivering på lipid-vand interface triacylglycerides, i overværelse af colipase og galdesalte, der er kendt som interfacial aktivering. For at hydroloysis-reaktionen finder sted, forankrer colipase lipase til lipid-vandmembranen i micellen, hvilket forårsager en overfladeændring på lipase. Colipases fire hydrofobe sløjfer interagerer med den hydrofobe atmosfære af triacylglyceridet. Dette initierer aktiv site binding til lipid, og lågåbning for at afsløre et mere hydrofobt miljø for triacylglycerol., Dette gør det muligt for triacylglycerol at interagere med vigtige aktive stedrester som den katalytiske triade. En bred vifte af lipase en .ymer kan findes i naturen. Selvom de forskellige former besætter forskellige protein stilladser, er de fleste bygget på en alfa/beta hydrolase fold og besidder en chymotrypsin-lignende bestående af en sur rest, en histidin og en serin nukleofil. I tilfælde af hestepancreatisk lipase består den katalytiske triade af . Denne katalytiske triade fungerer som de fleste findes i naturen., For det første danner asparaginsyre en hydrogenbinding med hans 263, hvilket øger PKA af histidinimida .ol nitrogen. Dette gør det muligt for histidin at fungere som en stærk generel base og deprotonere serinen. Den deprotonerede serin kan derefter tjene som en nukleofil og angribe estercarbonylen af en af fedtsyrerne på 1 eller 3-carbonerne i glycerolryggen i lipidsubstratet. Ved angreb af lipidet dannes et negativt ladet tetrahedralt mellemprodukt (reaktion 1). Det stabiliseres i O .yanionhullet med to rester: .,
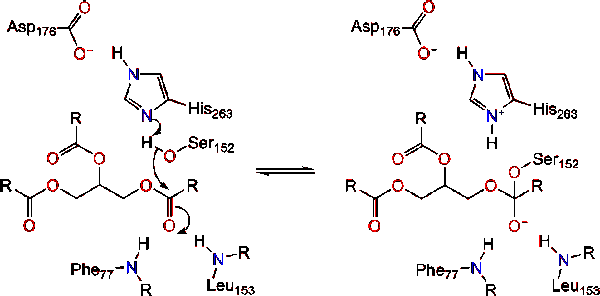
carbonylreformerne med glycerol-rygradssegmentet, der virker som den udgående gruppe (reaktion 2).
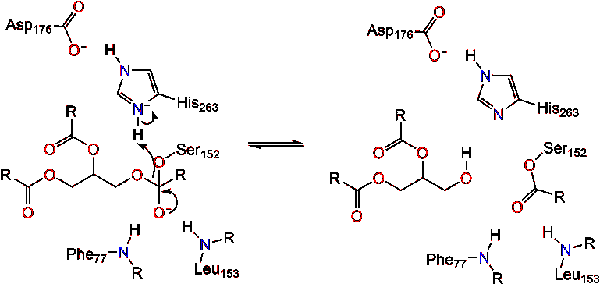
et vandmolekyle donerer derefter en proton til histidinet, hvilket skaber en reaktiv hydro .ylanion. Hydro .ylanionen kan derefter angribe carbonylcarbonet i lipidet og danne et andet negativt ladet tetrahedralt mellemprodukt, som stabiliseres i O .yanionhullet (reaktion 3).,
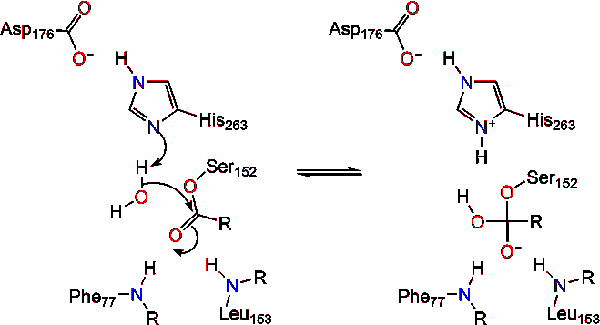
efter reformering af carbonylen frigives det katalytiske serin, og monoglycerid – og fedtsyremonomerer diffunderer væk (reaktion 4).
Hæmning af Pancreas Lipase
(lilla), en C11 alkyl phosphonate, er en kompetitiv hæmmer af pancreas lipase. Det binder direkte i den aktive site lomme. Der er også fem b-octylglucosid (grå og rød) molekyler, der forbinder med lipase., MUP danner hydrogenbindinger med : Ser 152 og Hans 263, som er en del af den katalytiske triade, og Phe 77 og Leu 153, som er den stabiliserende rester ligger i oxyanion hul .MUP blev vist at være af van Der deraals kontakter med hydrofobe sidekæder Ala 178, Phe 215, Pro l80, Tyr ll4, Leu 213 (vist i blåt).
protein – Substratinteraktioner
Lipase binder med adskillige hydrofobe kontakter. Som det ses her, interagerer lipasen med alkylgruppen af cholesteryllinoleat via en hydrofob rift i proteinet., Denne rift orienterer molekylet for at optimere lipolysereaktionen.
vist i denne scene er lipase fra gær Candida rugosa i med to molekyler cholesteryllinoleat (grå). De aktive rester på stedet, herunder Ser152, Asp176 og his263, er vist i Red stick repræsentation. Lipase kan rumme to lipidmolekyler på grund af det faktum, at det er to identiske underenheder katalyserer en identisk reaktion. Et lipasemolekyle kan katalysere to lipolysereaktioner ad gangen.,
klinisk betydning
pancreas lipase udskilles i tolvfingertarmen gennem kanalsystemet i bugspytkirtlen. I et sundt individ er det i meget lav koncentration i serum. Under ekstrem forstyrrelse af bugspytkirtelfunktionen, såsom pancreatitis eller kræft i bugspytkirtlen, kan bugspytkirtlen begynde at fordøje sig selv og frigive bugspytkirtelen .ymer inklusive bugspytkirtellipase i serum. Måling af serumkoncentration af pancreaslipase kan derfor hjælpe med diagnose af akut pancreatitis.., På grund af lipase ‘ s aktivitet i fordøjelsen og absorptionen af fedt har der været et voksende marked for lipaseinhibitorer til vægttabsmedicin. De mest populære er Orlistat (eller Xenical®), som er et naturligt produkt fra Streptomyces toxytricini og er hydrogenering produkt af lipostation – en irreversibel lipase inhibitor. Denne inhibitor virker også ved at binde Ser152, der producerer en ester, der hydrolyserer så langsomt, at den praktisk talt er irreversibel .
3D-strukturer af Lipase
Lipase 3D-strukturer