Lewis struktur af vand molekyle indeholder to enkeltsenge obligationer omkring ilt-atom. antal samlede valenselektroner af ilt og hydrogenatomer bruges til at tegne le .is struktur. Hvert trin i tegning le .is struktur af H2O er forklaret i denne tutorial.
H2O lewis struktur
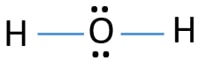
I lewis struktur af H2O, der er to enkelt obligationer omkring ilt-atom. Hydrogenatomer er fælles til O oxygenygenatom gennem enkeltbindinger. Der er også to ensomme par på O oxygenygenatom.,
vandmolekyle er et simpelt molekyle. Tegning le .is struktur af vandmolekyle er enkel end nogle af andre komplekse molekyler eller ioner. Forestil dig tegning le .is struktur af thiosulfat ion.
trin til tegning af Le .is-struktur af H2O
Der er nogle trin, der skal følges for at tegne en le .is-struktur korrekt. For H2O molecule, dens le .is struktur og disse trin er forklaret i detaljer i denne tutorial. Fordi vandmolekyle er enkel, er nogle af disse trin ikke brugt meget. I sådanne tilfælde nævnes de med respektive trin.,
- Find samlede antal elektroner i valance skaller af hydrogen atomer og ilt atom
- Samlet elektroner par som enlige par og obligationer
- Center atom valg
- markér enlige par på atomer
- Markér afgifter på atomer, hvis der er.
- kontroller stabiliteten og minimer ladninger på atomer ved at konvertere ensomme par til bindinger for at opnå den bedste le .is-struktur.
vigtigt: tegning korrekt le .is struktur er vigtigt at tegne resonansstrukturer korrekt.,
Samlet antal elektroner af valance skaller af H2O
Der er to af elementerne; hydrogen og O .ygen. Hydrogen er et gruppe IA-element og har kun en elektron i sin sidste skal (valensskal). O .ygen er en gruppe VIA element i det periodiske system og indeholder seks elektroner i sin sidste skal. Nu ved vi, hvor mange elektroner der er inkluderet i valensskaller af hvert atom.,
- valence elektroner givet af brint atomer = 1 * 2 = 2
- valence elektroner givet af ilt atomer = 6*1 = 6
- Samlet valence elektroner = 2 + 6 = 8
Alt valence elektroner par
Alt valance elektroner par = σ obligationer + π obligationer + enlige par i valence skaller
Alt elektron-par, er bestemt ved at dividere det samlede antal valence elektroner med to. For H2O er de samlede par elektroner 4 i deres valensskaller.,
Centeratom af H2O
for at være det centrale atom er evnen til at have større valance vigtig. Så fra brint og ilt, hvilket atom har den højeste valens? Maksimal valens af ilt er to. brintens eneste valens er en. Derfor bør o oxygenygenatom være centrum atom af H2O. nu kan vi tegne en skitse af H2O for at vise, hvordan atomer er placeret i molekylet.
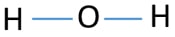
ensomme par på atomer
efter bestemmelse af centeratom og skitse af H2O-molekyle, skal vi begynde at markere ensomme par på atomer., Husk, at der er i alt fire elektronpar.
- Der er allerede to H-O-bindinger i den tegnede skitsestruktur. Nu er der kun to (4-2) elektronpar tilbage for at markere atomer.
- normalt bør de resterende elektronpar startes for at markere på udvendige atomer. Men i H2O er hydrogenatom de udvendige atomer, som ikke kan holde mere end to elektroner i sin sidste skal. Derfor kan vi ikke markere disse to elektronpar på hydrogenatomer.,
- marker Derefter de to elektroner par på center-atom, ilt

Markér afgifter på atomer
Der er ingen gebyrer på ilt-atom og hydrogen atomer.
kontroller stabiliteten og minimer ladninger på atomer ved at konvertere ensomme par til bindinger
fordi der ikke er nogen ladninger på atomer, er det ikke nødvendigt at reducere ladninger som et trin med at tegne den bedste le .is-struktur. Allerede fik vi den bedste le ?is-struktur til H2O.
spørgsmål
Hvad er de lignende le ?is-strukturer, som vand kan trækkes til?,
i Le .is-strukturen af vandmolekyle er der to sigma-bindinger og to ensomme par omkring svovlatom. Hydrogensulfid, o oxygenygendifluorid (F2O) har lignende le .is-strukturer som vand.
stil dine kemi spørgsmål og find svarene
relaterede Tutorials