Hvad er en Ion?
en ion er et atom eller molekyle, der bærer en elektrisk ladning.
ioner identificeres ved brug af et superskript for at vise tegnet og størrelsen på deres elektriske ladning.
Anioner og Kationer
Negativt ladede ioner kaldes anioner, og positivt ladede ioner kaldes kationer.,n-atom gevinster tre elektroner til at blive N3-
Eksempler på Kationer
- en natrium-atom mister en elektron til at blive Na+
- magnesium atom mister to elektroner til at blive Mg2+
- et jern atom mister tre elektroner til at blive Fe3+
- vand reagerer med H+ til at danne molekylære kation H3O+
Ion Dannelsen
Ioner form, når du laver så minimerer de samlede potentielle energi af kemiske arter, der er involveret i den kemiske reaktion.,Ofte opnås dette ved at tillade atomer af forskellige elementer at opnå en fuld skal af elektroner.
Overvej salt lithium fluorid:
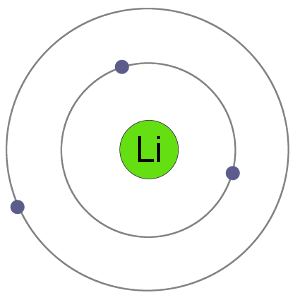
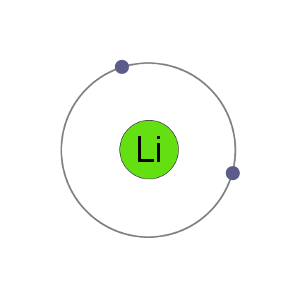
Lithium atomer har 3 elektroner, hvilket betyder at de har elektroner i to tanke: 2 i den første shell og 1 i second.By taber en elektron til at blive en kation, lithium får en stabil electron arrangement, der er identiske med ædel gas helium.,
Li-Atom
Li+ Kation
Fluor-atomer har 9 elektroner, hvilket betyder at de har 2 i den første shell og 7 i second.By få en elektron til at blive en anion fluorid ion får en stabil electron arrangement, der er identiske med ædel gas neon.,”e9c2d99c83″>
Og så redox-reaktion af natrium med klor for at danne en ionisk forbindelse er energimæssigt favorabelt:
Reduktion af klor: Cl2 + 2e- → 2 cl-
Generelle reaktion: 2Na + Cl2 → 2NaCl
Ion Størrelser
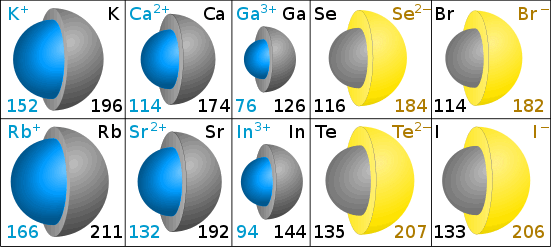
Der er mindre end den oprindelige atom – at overveje, hvordan natrium atom har elektroner i tre skaller, mens natrium-ion har elektroner i kun to skaller.,Med flere elektroner er anioner større end det oprindelige atom.
Ionstørrelser måles ved den ioniske radius.
ioniske radier i Picometre
den grå farve i diagrammerne viser størrelsen på det originale atom. Den blå (kation) og gul (anion) viser størrelsen af ionen. (Diagrammer af Chris King.)

ionforbindelser
ionforbindelser, som natriumchlorid (NaCl) er dannet på grund af den elektrostatiske tiltrækning mellem anioner og kationer.,Ioniske forbindelser er elektrisk neutrale, fordi det samlede antal positive ladninger og det samlede antal negative ladninger altid er ens.
i betragtning af de kemiske elementer findes den højeste tendens til at danne ioniske forbindelser i de mindst elektronegative metaller og de mest elektronegative ikke-metaller.
elektriske ledere
ioner kan bære elektrisk strøm; dette kan observeres i elektrokemiske celler og for eksempel i plasma.
generelt bærer faste ionforbindelser ikke elektrisk strøm, fordi ionerne er låst i faste positioner i et krystalgitter.,Ioniske forbindelser fører kun elektricitet, når de smeltes, eller når de opløses i opløsning, når ionerne frigives fra krystalgitteret og bliver mobile.