Den stærkt organiserede strukturer af proteiner er virkelig mesterværker af kemiske arkitektur. Men højt organiserede strukturer har en tendens til at have en vis delikatesse, og det gælder proteiner. Denaturering er det udtryk, der anvendes til enhver ændring i den tredimensionelle struktur af et protein, der gør det ude af stand til at udføre sin tildelte funktion. Et denatureret protein kan ikke gøre sit job. (Undertiden er denaturering lig med udfældning eller koagulering af et protein; vores definition er lidt bredere.,) En lang række reagenser og betingelser, såsom varme, organiske forbindelser, pH-ændringer og tungmetalioner kan forårsage protein denaturering.
|
Method |
Effect on Protein Structure |
|---|---|
|
Heat above 50°C or ultraviolet (UV) radiation |
Heat or UV radiation supplies kinetic energy to protein molecules, causing their atoms to vibrate more rapidly and disrupting relatively weak hydrogen bonding and dispersion forces., |
|
Brug af organiske forbindelser, såsom ethyl alkohol |
Disse forbindelser er i stand til at indgå i intermolekylære hydrogen binding med protein-molekyler, der forstyrrer intramolekylære hydrogenbindinger i protein., |
|
Salte af heavy metal-ioner, såsom kviksølv, sølv og bly |
Disse ioner danne stærke bånd med carboxylat anioner af sure aminosyrer eller SH grupper af cystein, forstyrrer ioniske obligationer og disulfid-bindinger. |
|
Alkaloid reagenser, såsom syre, garvesyre (anvendes til garvning af læder) |
Disse reagenser kombinere med positivt ladede aminosyrer grupper i proteiner til at forstyrre ioniske obligationer., |
Enhver, der har stegt et æg har observeret denaturering. Den klare æggehvide bliver uigennemsigtig, når albumin denaturerer og koagulerer. Ingen har endnu vendt denne proces. I betragtning af de rette omstændigheder og tilstrækkelig tid kan et protein, der har udfoldet sig under tilstrækkeligt blide forhold, genfolde sig og kan igen udvise biologisk aktivitet (figur 2.5.1). Sådanne beviser tyder på, at den primære struktur i det mindste for disse proteiner bestemmer den sekundære og tertiære struktur., En given sekvens af aminosyrer synes at vedtage sin særlige tredimensionelle (3D) arrangement naturligt, hvis betingelserne er rigtige.
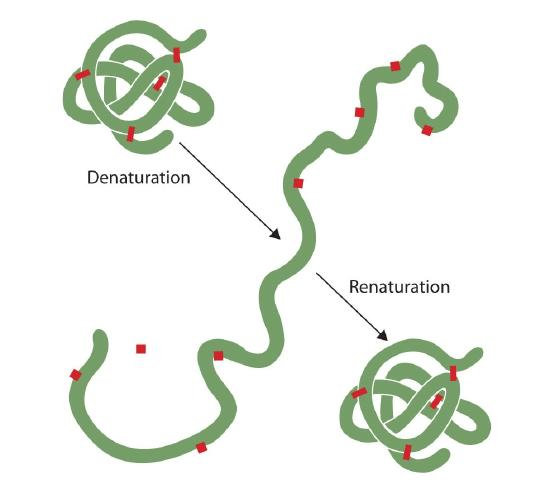
de primære strukturer af proteiner er ret robuste., Generelt er der brug for temmelig kraftige betingelser for at hydrolysere peptidbindinger. På de sekundære gennem kvaternære niveauer er proteiner imidlertid ret sårbare over for angreb, selvom de varierer i deres sårbarhed over for denaturering. De fint foldede kugleformede proteiner er meget lettere at denaturere end de hårde, fibrøse proteiner i hår og hud.
resum Proteins
proteiner kan opdeles i to kategorier: fibrøst, som har tendens til at være uopløseligt i vand, og kugleformet, som er mere opløseligt i vand. Et protein kan have op til fire niveauer af struktur., Den primære struktur består af den specifikke aminosyresekvens. Den resulterende peptidkæde kan danne en a-Heli.eller β-plisseret plade (eller lokale strukturer ikke så let kategoriseret), som er kendt som sekundær struktur. Disse segmenter af sekundær struktur inkorporeres i den tertiære struktur af den foldede polypeptidkæde. Den kvaternære struktur beskriver arrangementerne af underenheder i et protein, der indeholder mere end en underenhed., Fire hovedtyper af attraktive interaktioner bestemmer formen og stabiliteten af det foldede protein: ionbinding, hydrogenbinding, disulfidforbindelser og dispersionskræfter. En lang række reagenser og betingelser kan få et protein til at udfolde sig eller denaturere.