Úvod
lipáza katalyzuje odbourávání lipidů hydrolyzací esterů mastných kyselin. Jeho funkce je důležitá pro trávení a podporu absorpce tuků ve střevech. Lipáza se primárně nachází v pankreatu a vylučuje se, ale Nachází se také ve slinách a žaludku.
- pankreatická lipáza (PDB ID: 1hpl), která je zobrazena vpravo, je karboxylová esterová hydroláza. Také se běžně nazývá pankreatická triacylglycerolová lipáza a její číslo třídy enzymů je E. C. 3.1.1.3 .,
- lipáza stimulovaná žlučovou solí (BSSL) se nachází v mateřském mléce.
- hormonálně citlivá lipáza (LIPE) hydrolyzuje různé estery. Podrobnosti viz hormonálně citlivá lipáza.
- monoacylglycerolová lipáza (MAGL) hydrolyzuje intracelulární triglyceridy na mastné kyseliny a glycerol. MAGL funguje společně s LIPE. Podrobnosti viz Monoglycerid lipáza.
reakce katalyzovaná enzymem je uvedena níže.
Další členění nakonec vyústí v 2-monoacylglycerols a volných mastných kyselin ., Hloubkovou diskusi o mechanismu lze nalézt v části katalytického mechanismu lipázy. Stanovení struktury a funkce lipázy bylo postupným procesem. Lipázová aktivita byla poprvé prokázána v pankreatu Claude Bernardem v roce 1846. Až v roce 1955 však Mattson a Beck prokázali vysokou specificitu pankreatické lipázy pro triglyceridové primární estery . V posledních letech se stanovení krystalové struktury pankreatické lipázy stalo primárním zaměřením, protože mnoho vědců pracovalo na dalším postupu.,
Viz také
- Molekulární Hřiště/Pankreatické Lipázy
- Lipáza víko morph
- Hormon senzitivní lipáza
- Lipasa z Candida antarctica v uzavřeném stavu
- Monoglycerické lipázy
- Lidské žaludeční lipáza
- Lipáza (hebrejsky)
- Lipidů metabolismus
Struktura
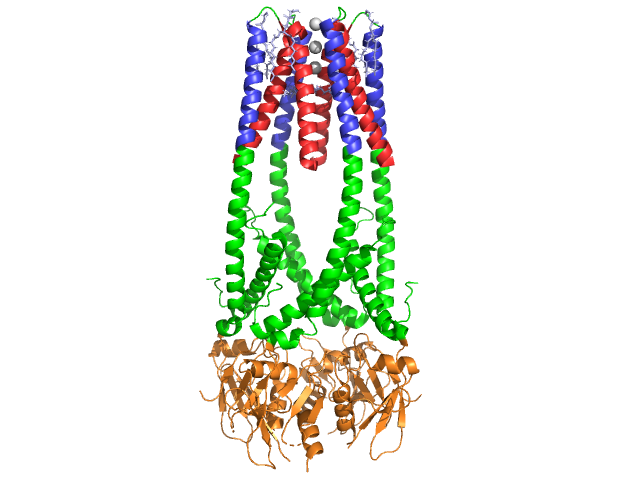
Pankreatické lipázy je 50 kDa protein., Zatímco krystalografické asymetrické jednotky obsahuje dva identické řetězce, informace (POZNÁMKA 350) v datovém souboru 1hpl naznačuje, že dimer je krystalizace artefakt, a to ve funkční podobě (také nazývané biologické shromáždění) je jeden řetězec (monomer). Řetězec se skládá ze 449 zbytků . S lipázy (v jedné podjednotky) patří 102 zbytky, které vytvářejí 13 alpha helices, zobrazeny v červené, a 139 zbytků zapojených do beta listy v celkové výši 28 pramenů, je uvedeno ve zlatě. Alfa helices tvoří 22% proteinu, zatímco beta listy obsahují 30%., Každý řetězec obsahuje dva dobře definované . Terminální doména n, zobrazená modře, je charakterizována záhybem alfa / beta hydrolázy. Zatímco doména terminálu C, zobrazená zeleně, obsahuje sendvič beta listu, který interaguje s kolipázou . Každá monomerová a dimerová struktura lipázy je držena pohromadě disulfidovými vazbami, vodíkovými vazbami a elektrostatickými interakcemi (solné můstky). Lipáza má mezi zbytky cysteinu celkem 12. jsou tvořeny mezi pozitivní náboj atomů dusíku (modrá) v Arg a Lys, a negativní atomy kyslíku (červeně) v Asp a Glu zbytků., (žlutě) také stabilizuje enzym mezi atomy hlavního řetězce a postranního řetězce. Lipáza má zřetelné rozložení zbytků (purpurový spacefill představuje polární zbytky). Hydrofobní kolaps přispívá k velké části sekundárních a terciárních struktur, protože (zobrazeno v bílé barvě) tvoří vnitřek proteinu, zatímco polární zbytky (průhledná modrá) jsou na povrchu . Kromě toho má lipáza dvě . Jeden je pohřben v každé monomerní podjednotce. Iont vápníku je nezbytný pro skládání bílkovin a enzymovou aktivitu ., Obrázek ukazuje zelený iont vápníku v podjednotce a, koordinovaný zbytky Glu187, Arg190, Asp192 a Asp195. Náboj Ca (+2) je stabilizován negativně nabitými zbytky glutamátu a aspartátu a atomy kyslíku ze dvou molekul vody (růžové).
kromě toho má lipáza jedinečnou (zelenou), která blokuje vstup rozpouštědla do aktivního místa (červená). Víko je 25-zbytková spirálová struktura, která chrání oxyanionový otvor., Víko (žlutá) je obzvláště důležité, aby substrát závazné, jak to prochází dramatický posun, který změní sekundární struktura lipázy vazebné místo z (aktivní místo v červeném) do (aktivní stránky v modré barvě, triacylglyceride v spacefill) (viz Lipázy víko morph pro animaci tohoto přechodu). Otevření víka je doprovázeno změnou sekundární struktury z většinou beta-rozšířeného potvrzení na strukturu, kde je více než polovina aktivního místa vytvořena z alfa helixů .,
Koenzym Kolipázy
lipáza je aktivována kolipázou, koenzymem, který se váže na C-terminální nekatalytickou doménu lipázy. Colipáza je 10kda protein, který je vylučován pankreasem v neaktivní formě. To má pět zachovaných (zobrazeny žlutě) , a 2 – hydrofilní povrch (místo lipázy C-terminální interakce – zobrazeny modře) a hydrofobní povrch (obsahuje více hydrofobních smyček překlenout lipidů je znázorněno v bílém). Trypsin pak aktivuje kolipázu dříve, než může kofaktor interagovat s lipázou.,
Kolipáza musí být přítomna pro aktivaci lipázy a působí jako můstek mezi lipázou a lipidem. Když se kolipáza váže, aktivní lipáza je stabilizována pro hydrofobní interakci s triacylglyceridy . Bez přítomnosti kolipázy by akumulace amfifilů na rozhraní olej / voda v dvanáctníku zabránila vazbě pankreatické lipázy na její substrát. . Colipase a lipázy jsou opakem aktivního místa na C-terminální (kontakty jsou regiony, růžové a žluté, s molekulami vody je znázorněno v tmavší modrá). Enzymy jsou vázány polárními interakcemi , jako jsou a .,
v přítomnosti kolipázy se aktivuje enzym, který pohybuje (znázorněno červeně, Aktivní místo v zelené), který se skládá z aminokyselin 216-239. Klapka N-terminal se pohybuje společně s doménou C-terminal, aby odhalila Aktivní místo (zelené), což jí umožňuje vázat se substrátem. Předpokládá se, že tato flexibilita může mít význam při vazbě komplexu kolipáza-lipáza s rozhraním voda-lipid. Reorganizace klapky také vyvolává druhou konformační změnu, která vytváří oxyanionový otvor.,
katalytický mechanismus lipázy
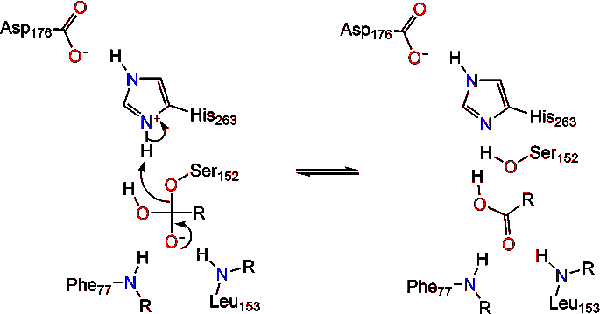
aktivace lipázy na rozhraní lipidů a vody triacylglyceridů v přítomnosti kolipázy a žlučových solí je známá jako interfaciální aktivace. Aby došlo k hydrolýzní reakci, kolipáza ukotvuje lipázu na lipidově-vodní membránu micely, která způsobuje změnu povrchu na lipáze. Colipázové čtyři hydrofobní smyčky interagují s hydrofobní atmosférou triacylglyceridu. To iniciuje aktivní stránky vazba na lipid a víko otevření odhalit více hydrofobní prostředí pro triacylglycerolu., To zase umožňuje triacylglycerolu interagovat s klíčovými aktivními zbytky místa, jako je katalytická triáda. V přírodě lze nalézt různorodou škálu lipázových enzymů. I když různé formy zaujímají rozmanité proteinové lešení, většinou jsou postaveny na alfa/beta hydrolázy složit a mít chymotrypsin-like skládá z kyselé zbytky, histidin, serin nukleofil. V případě lipázy pankreatu koní se skládá z katalytické triády . Tato katalytická triáda funguje jako většina V přírodě., Za prvé, kyselina asparagová tvoří vodíkovou vazbu s jeho 263, čímž se zvyšuje pKa dusíku histidinu imidazolu. To umožňuje histidinu působit jako silná obecná základna a deprotonovat serin. Deprotonovaný serin pak může sloužit jako nukleofil a napadnout Ester karbonylu jedné z mastných kyselin na 1 nebo 3 uhlících glycerolové páteře lipidového substrátu. Při útoku na lipid se vytvoří negativně nabitý čtyřstěnný meziprodukt (reakce 1). Je stabilizován v oxyanionovém otvoru dvěma zbytky: .,
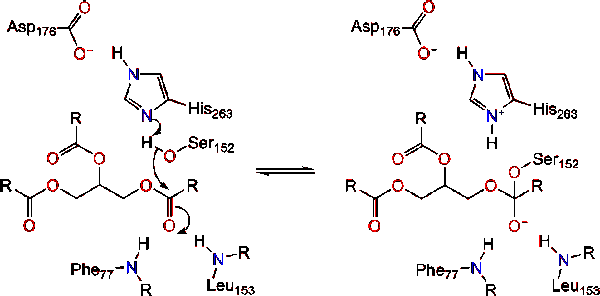
karbonylové reformy s glycerol páteře segmentu působí jako opuštění skupiny (Reakce 2).
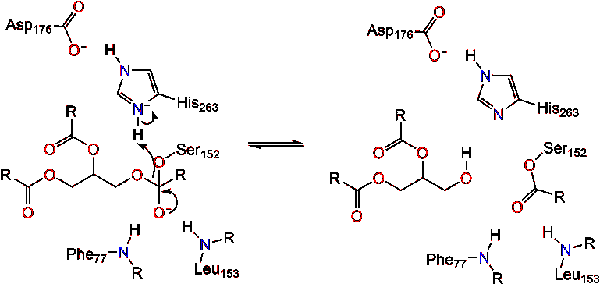
molekuly vody pak daruje proton na histidin, vytváří reaktivní hydroxylový anion. Hydroxylových aniontů může pak zaútočit na uhlíku karbonylové lipidů, které tvoří další záporně nabité tetraedrický meziprodukt, který se stabilizuje na oxyanion otvoru (Reakce 3).,
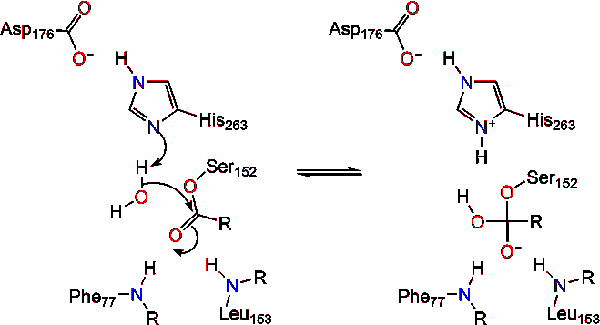
Po reformaci karbonylové katalytický serin je propuštěn a monoglycerické a mastné kyseliny monomerů šířit dál (Reakce 4).
Inhibice Pankreatické Lipázy
(fialová), C11 alkyl disodný, je kompetitivní inhibitor pankreatické lipázy. Váže se přímo do kapsy aktivního místa. Existuje také pět molekul B-oktylglukosidu (šedé a červené), které se spojují s lipázou., MUP tvoří vodíkové vazby s : Ser 152 a Jeho 263, které jsou součástí katalytické triády, a Phe 77 a Leu 153, které jsou stabilizující zbytky se nachází v oxyanion díry .MUP bylo prokázáno, že van der Waals kontakty s hydrofobními bočními řetězy Ala 178, Phe 215, pro l80, Tyr ll4, Leu 213 (zobrazeno v modré barvě).
interakce protein – substrát
lipáza se váže s četnými hydrofobními kontakty. Jak je vidět zde, lipáza interaguje s alkylovou skupinou cholesteryllinoleátu hydrofobní trhlinou uvnitř proteinu., Tato trhlina orientuje molekulu k optimalizaci lipolýzy.
zobrazeno v této scéně je lipáza z kvasinek Candida rugosa se dvěma molekulami cholesteryllinoleátu (šedá). Aktivní zbytky místa včetně Ser152, Asp176 a His263 jsou zobrazeny v červené tyči. Lipáza může pojmout dvě molekuly lipidů vzhledem k tomu, že se jedná o dvě identické podjednotky katalyzují identickou reakci. Jedna molekula lipázy může katalyzovat dvě lipolýzy reakce najednou.,
klinický význam
pankreatická lipáza se vylučuje do dvanáctníku potrubním systémem pankreatu. U zdravého jedince je ve velmi nízké koncentraci v séru. Při extrémním narušení funkce pankreatu, jako je pankreatitida nebo rakovina pankreatu, se pankreas může začít trávit sám a uvolňovat pankreatické enzymy včetně pankreatické lipázy do séra. Měření sérové koncentrace pankreatické lipázy proto může pomoci při diagnostice akutní pankreatitidy.., Vzhledem k aktivitě lipázy při trávení a vstřebávání tuku, tam byl rostoucí trh pro inhibitory lipázy pro hubnutí léčiv. Nejvíce populární je Orlistat (Xenical nebo®), což je přírodní produkt ze Streptomyces toxytricini a je hydrogenační produkt lipostation – nevratný lipázy inhibitor. Tento inhibitor také působí vazbou Ser152, produkující ester, který hydrolyzuje tak pomalu, že je prakticky nevratný .
3D struktury lipázy
lipázy 3D struktury