co je to iont?
iont je atom nebo molekula, která nese elektrický náboj.
ionty jsou identifikovány pomocí horního indexu pro zobrazení znaménka a velikosti jejich elektrického náboje.
Anionty a Kationty
Záporně nabité ionty se nazývají anionty a kladně nabité ionty se nazývají kationty.,n atom získá tři elektrony, aby se stal N3-
Příklady Kationtů
- sodný atom ztratí elektron, aby se stal Na+
- hořčíku atom ztratí dva elektrony, aby se stal Mg2+
- iron atom ztrácí tři elektrony, aby se stal Fe3+
- voda reaguje s H+ za vzniku molekulárního kation H3O+
Vytváření Iontů
Ionty se tvoří, když přitom minimalizuje celkovou potenciální energie chemické látky, které se podílejí na chemické reakci.,Toho je často dosaženo tím, že atomy různých prvků umožňují dosáhnout plného pláště elektronů.
Zvážit, soli lithia, fluoridů:
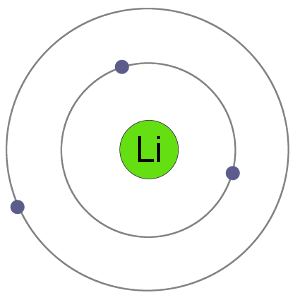
Lithiové atomy mají 3 elektrony, což znamená, že mají elektrony ve dvou skořepin: 2 v první shell a 1 v second.By ztrácí elektron, aby se stal kation, lithium dostane stabilní elektronové uspořádání, totožný s tím z vzácných plynů helium.,
Li Atom
Li+ Kation
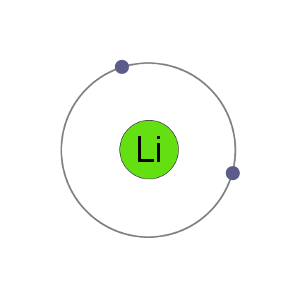
atomy Fluoru 9 elektronů, což znamená, že mají 2 v první shell a 7 v second.By získá elektron, aby se stal aniontů fluoridů ion dostane do stabilní elektronové uspořádání, stejný vzácný plyn neon.,“e9c2d99c83″>
A tak redoxní reakce sodíku s chlorem tvoří iontové sloučeniny je energeticky příznivé:
Snížení chloru: Cl2 + 2e- → 2Cl-
Celková reakce: 2Na + Cl2 → 2NaCl
Ion Velikosti
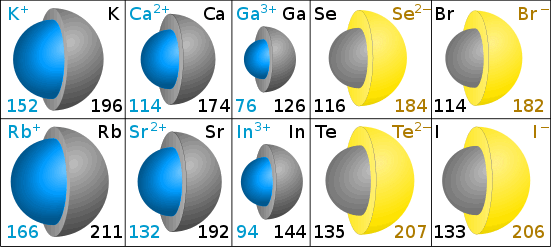
Kationty jsou menší než původní atom – zvažte, jak atom sodíku má elektrony ve tři skořápky, zatímco sodíkových iontů má elektrony pouze ve dvou mušlí.,S více elektrony jsou anionty větší než původní atom.
velikosti iontů se měří iontovým poloměrem.
iontové poloměry v Pikometrech
šedá barva v diagramech ukazuje velikost původního atomu. Modrá (kation) a žlutá (aniont) ukazuje velikost iontu. (Diagramy Chris King.)

Iontové Sloučeniny
Iontové sloučeniny, jako například chlorid sodný (NaCl) jsou vytvořeny z důvodu elektrostatické přitažlivosti mezi anionty a kationty.,Iontové sloučeniny jsou elektricky neutrální, protože celkový počet kladných nábojů a celkový počet záporných nábojů jsou vždy stejné.
vzhledem k chemickým prvkům existuje nejvyšší tendence k tvorbě iontových sloučenin v nejméně elektronegativních kovech a nejvíce elektronegativních nekovech.
elektrické vodiče
ionty mohou přenášet elektrický proud; to lze pozorovat například v elektrochemických buňkách a v plazmě.
obecně pevné iontové sloučeniny nenesou elektrický proud, protože ionty jsou uzamčeny v pevných polohách v krystalové mřížce.,Iontové sloučeniny vedou elektřinu pouze při roztavení nebo při rozpuštění v roztoku, když se ionty uvolňují z krystalové mřížky a stávají se mobilními.