vysoce organizovaných struktur proteinů jsou opravdu mistrovská díla chemických architektury. Ale vysoce organizované struktury mají tendenci mít určitou pochoutku, a to platí o bílkovinách. Denaturace je termín používaný pro jakoukoli změnu v trojrozměrné struktuře proteinu, který jej činí neschopným vykonávat svou přiřazenou funkci. Denaturovaný protein nemůže dělat svou práci. (Někdy se denaturace rovná srážení nebo koagulaci proteinu; naše definice je o něco širší.,) Široká škála činidel a podmínek, jako je teplo, organické sloučeniny, změny pH a ionty těžkých kovů, mohou způsobit denaturaci bílkovin.
|
Method |
Effect on Protein Structure |
|---|---|
|
Heat above 50°C or ultraviolet (UV) radiation |
Heat or UV radiation supplies kinetic energy to protein molecules, causing their atoms to vibrate more rapidly and disrupting relatively weak hydrogen bonding and dispersion forces., |
|
Použití organických sloučenin, např. ethanol, |
Tyto sloučeniny jsou schopné zapojit se do mezimolekulární vodíkové vazby s proteiny molekuly, narušuje intramolekulární vodíkové vazby v proteinu., |
|
Solí iontů těžkých kovů, jako je rtuť, stříbro a olovo, |
Tyto ionty tvoří silné vazby s karboxylát anionty kyselé aminokyseliny nebo SH skupin cysteinu, narušení iontové vazby a disulfidové vazby. |
|
Alkaloid činidla, jako je kyselina tříslová (použity v činění kůže) |
Tyto činidla spojit s kladně nabitými amino skupinami v proteinech k narušení iontové vazby., |
každý, kdo smažil vejce, pozoroval denaturaci. Čirá vaječná bílá se stává neprůhlednou, protože albumin denaturuje a koaguluje. Tento proces zatím nikdo nezvrátil. Nicméně, vzhledem k tomu, správné okolnosti a dost času, protein, který se rozložil pod dostatečně jemný podmínek může znovu složte a může opět vykazují biologickou aktivitu (viz Obrázek 2.5.1). Takové důkazy naznačují, že alespoň u těchto proteinů určuje primární struktura sekundární a terciární strukturu., Zdá se, že daná sekvence aminokyselin přirozeně přijímá své konkrétní trojrozměrné (3D) uspořádání, pokud jsou podmínky správné.
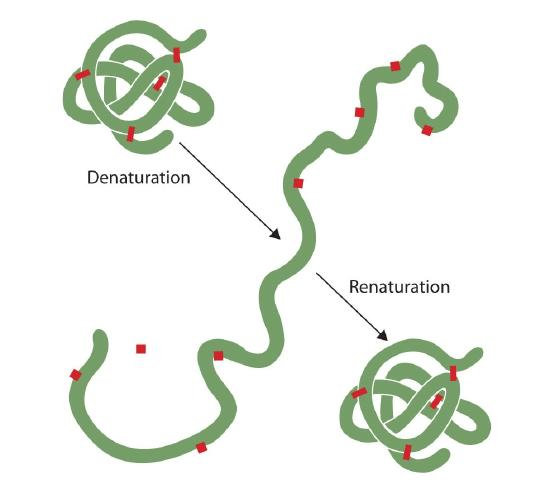
primární struktury proteinů jsou poměrně robustní., Obecně platí, že pro hydrolyzování peptidových vazeb jsou zapotřebí poměrně silné podmínky. Na sekundárním prostřednictvím kvartérních hladin jsou však proteiny docela náchylné k útoku, i když se liší svou zranitelností vůči denaturaci. Jemně složené kulovité proteiny jsou mnohem snazší denaturovat než tvrdé, vláknité proteiny vlasů a kůže.
souhrn
proteiny lze rozdělit do dvou kategorií: vláknité, které mají tendenci být nerozpustné ve vodě a kulovité, které jsou rozpustnější ve vodě. Protein může mít až čtyři úrovně struktury., Primární struktura se skládá ze specifické sekvence aminokyselin. Výsledný peptidový řetězec může tvořit α-helix nebo β-plisovaný list (nebo lokální struktury, které nejsou tak snadno roztříděny), který je známý jako sekundární struktura. Tyto segmenty sekundární struktury jsou začleněny do terciární struktury složeného polypeptidového řetězce. Kvartérní struktura popisuje uspořádání podjednotek v proteinu, který obsahuje více než jednu podjednotku., Tvar a stabilitu složeného proteinu určují čtyři hlavní typy atraktivních interakcí: iontové vazby, vodíkové vazby, disulfidové vazby a disperzní síly. Široká škála činidel a podmínek může způsobit, že se protein rozvine nebo denaturuje.